がん病態生理学分野
概要
がんを全身疾患として捉え、がん細胞と周辺の正常細胞との相互作用、転移の分子メカニズム、そしてがんが身体に及ぼす悪影響について個体レベルで研究し、新しいがん医療の創生を目指しています。

当分野では、主に遺伝子改変や移植によるがんのマウスモデルを用いて、以下の研究を推進しています。
- がん細胞は、周辺の正常細胞から生存や浸潤・転移に関わる様々な刺激を受けています。このような「がん微小環境」を標的とした、新しい治療の開発を行っています。
- 大腸がんの発生から転移に至るまでの過程を再現できるマウスモデルを用いて「転移」のメカニズム解明を進めています。特に、がん幹細胞と呼ばれる、再発・転移・治療抵抗性の元凶と考えられている細胞を標的とした革新的な治療戦略を開発しています。
- 進行がん患者では、複合的な代謝異常を伴って筋肉が著しく減少する、がん悪液質と呼ばれる状態がしばしば発生します。この「がん悪液質」の病態生理解明に基づいた、画期的な診断法・治療法の開発を進めています。
目指すもの
がんの基礎的な研究から得られた成果を、愛知県がんセンター病院各部門との緊密な連携によって臨床応用につなげようとしています。特に、転移を伴う治療困難ながんや、がん患者の生活の質や予後を悪化させるがん悪液質に対する新しい治療法の開発を目指しています。
連絡先
愛知県がんセンター研究所
がん病態生理学分野 分野長
青木 正博(あおき まさひろ)
〒464-8681 名古屋市千種区鹿子殿1-1
Tel:052-762-6111 (内線) 7050
E-mail:msaoki@aichi-cc.jp
研究内容 一般の方へ
研究活動の概要
がん病態生理学分野では、がんが体の中でどのように発生し、さらに悪性化して転移するようになるか、そしてがんが体にどのような影響を与えるかを研究しています。がんは私たちの体を構成する細胞に遺伝子の異常が積み重なってできます。私たちは、がんが自然に発症するよう遺伝子を操作したマウスを用いて、(1)がん細胞とその周辺の正常な細胞までを含む「がん微小環境」(2)がん転移のメカニズム(3)がん患者の多くに見られ、筋肉の萎縮を伴って体重が減少する「がん悪液質」の3点に着目し、がんの発生、悪性化そして転移に至るメカニズムを明らかにすることに力を注いでいます。
研究テーマ紹介
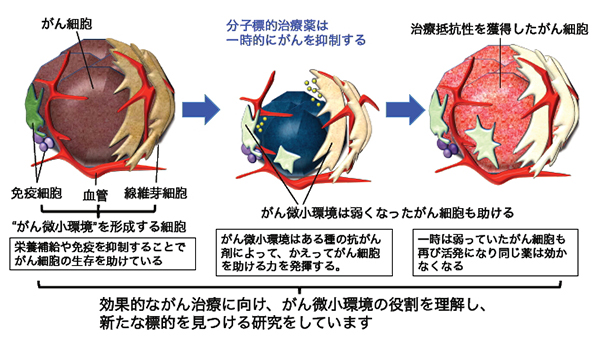
1)がん微小環境の研究 ~がんの悪性化、転移を助け、薬剤への抵抗性にも関わる「がん微小環境」
がん細胞は、悪賢く臨機応変で、薬剤の投与など周囲からの刺激に変幻自在に対応し、さらには周囲の正常な細胞を利用してより居心地の良い環境を作り出してしまいます。このがんとそれを取り巻く正常細胞までを含む範囲を「がん微小環境」と呼んでいますが、ここががんの成長や浸潤、転移を手助けしていることがわかってきています。
近年、がんの増殖に関わるタンパク質をピンポイントで攻撃する分子標的治療薬が開発され、白血病など血液のがんでは、症状が消えてがん細胞が検出できないほど減少する「寛解」も夢ではなくなっています。しかし、大腸がんや肺がんをはじめとする固形がんでは、治療の初期には効果が認められても、いずれ薬に対する抵抗性を獲得し薬が効かなくなることが治療の妨げとなっています。がん細胞が体の中で薬剤への抵抗性を獲得するメカニズムについて、私たちの研究室では、大腸がんを自然に発症するよう遺伝子操作を行ったマウスを用いて研究を続けています。その結果、大腸がんが分子標的治療薬に対して抵抗性を獲得する際にも、「がん微小環境」の正常な細胞を利用していることを発見しました。
このように当分野ではこの「がん微小環境」ががん細胞に対しどんな役割を果たしているのかを明らかにし、その成果を新たな治療法の開発につなげるべく研究をしています。
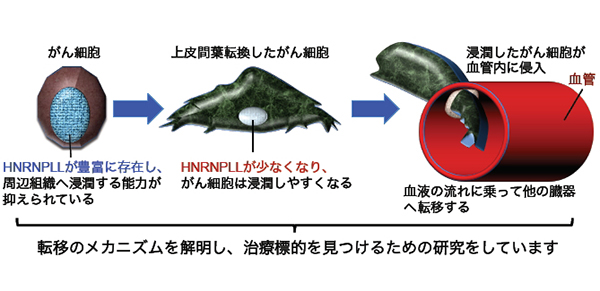
2)転移の研究 ~大腸がん転移を制御するタンパク質HNRNPLL
がんの治療を難しくする原因はいろいろ挙げられますが、「転移」はその代表的なものと言えます。転移とは、がん細胞がもとの発生した臓器から他の臓器に移動してそこで増殖することです。大腸がんの場合も多臓器への転移を伴っていると治療は難しくなりますが、残念ながら大腸がん細胞が転移するメカニズムは十分に解明されておらず、転移を制御することは極めて困難な状態です。
私たちはこの問題に最新の遺伝子工学と実験動物(マウス)を使って取り組んでいます。その過程で、HNRNPLLというタンパク質が、大腸がん細胞の転移を抑える働きがあることをつきとめ、さらに、大腸の上皮(表面)にできたがん細胞が、周囲に規則正しく並んでいる細胞の配置を乱す「上皮間葉転換」という現象を起こすと、転移のブレーキ役であったHNRNPLLが減少し、大腸がん細胞が周囲の組織に侵入、さらには肺に転移しやすくなることを発見しました。
- 読売新聞朝刊平成29年4月12日掲載「大腸がん転移抑制 たんぱく質発見」 [PDFファイル/212KB]
(※この記事は読売新聞社の許諾を得て転載しています。) - 中日新聞朝刊平成29年4月12日掲載「大腸がんの転移抑制 タンパク質特定」 [PDFファイル/177KB]
(※この記事は中日新聞社の許諾を得て転載しています。)
私たちは、このような転移を制御するタンパク質について解析し、転移の新しい予防・治療法の開発につなげたいと考えています。
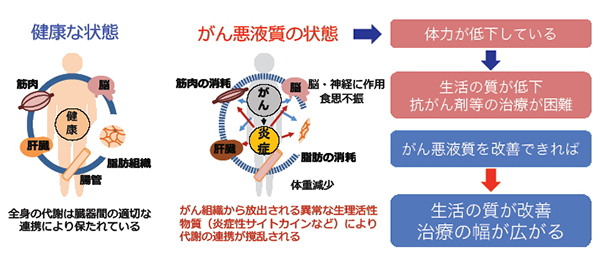
3)がん悪液質の研究 ~「がん悪液質」が招く体重の減少や筋力の低下
「悪液質」は栄養不足という原因以上に体が痩せ、筋肉が衰えていく状態のことを指します。悪液質はがんだけではなく、心臓や呼吸器の慢性疾患などでも起こりますが、がんを原因とする悪液質を特に「がん悪液質」と言います。
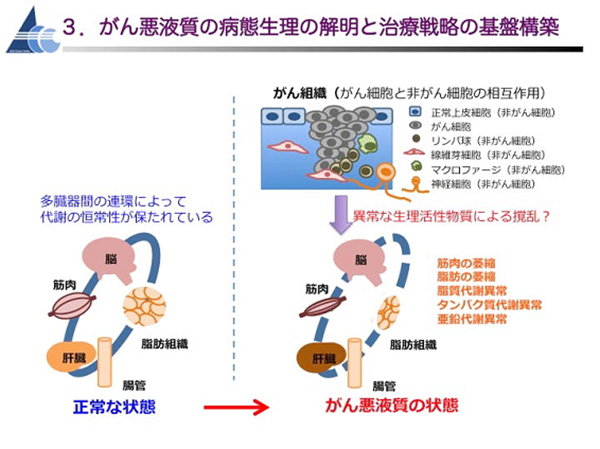
体の代謝のバランスは多くの臓器間の連携により保たれています。がんが進行するとその連携が乱れて代謝のバランスが崩れ、「がん悪液質」になります。この原因の一つとして知られているのが炎症性サイトカインと呼ばれる物質が過剰に放出されることです。がんや周辺細胞から作り出された炎症性サイトカインが慢性的な炎症を起こし、肝臓や筋肉、脂肪組織など多臓器間の連携を攪乱して代謝の異常をきたし、体重の減少や筋力低下を招くと考えられています。(下図)私たちは、がん悪液質の症状を発症する「がん悪液質モデルマウス」を使って、炎症性サイトカインなどが「がん悪液質」を引き起こす仕組みを明らかにする研究を進めています。この「がん悪液質」の予防や治療ができれば、患者さんの生活の質が改善されるだけでなく、患者さんの体に負担がかかるより効果の高い強い薬剤の使用も可能になるなど、治療の選択肢が広がることが期待されています。
目指すもの
私たちの分野では、薬剤への抵抗性や転移に関わる「がん微小環境」を標的にした治療法を開発し、それを既存の抗がん剤や分子的治療薬と併用することで、薬への抵抗性を生じさせずに治療を継続できるようにすること、また転移を制御するタンパク質を突き止め、それらを起点に治療困難な転移性のがんの予防・治療ができる薬の開発につなげることに重点を置いています。さらにがん悪液質を予防、または進行を遅らせる方法をみつければ、患者の生活の質が向上するのみならず、がん治療の選択肢を増やすことにつながります。私たちはマウスを用いたがん研究の成果を、治療の第一線の愛知県がんセンター病院と緊密に連携することで先進的ながんの治療法の開発に結びつけることを目指しています。
研究内容 専門家の方へ
がん病態生理学分野では、固形がん(主に大腸がんと肺がん)のマウスモデルを用いて、がんの発症・悪性化における微小環境の役割、転移の分子メカニズム、がん悪液質の病態生理の3つを生体レベルで解明し、愛知県がんセンター中央病院との連携により新たな治療法の確立につなげることを目指しています。以下のような研究が進行中です。
1)がん微小環境の役割の解明
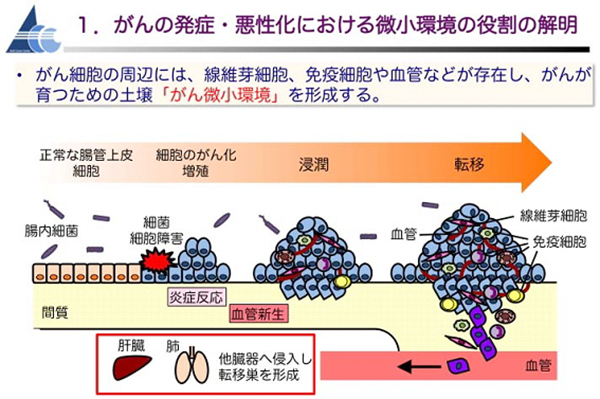
がん細胞の周辺には、線維芽細胞、マクロファージ・リンパ球などの免疫細胞、血管細胞など様々な細胞が存在し、がんが育つための土壌「がん微小環境」を形成しています。がん細胞は、この微小環境を上手に利用して、腫瘍の成長や浸潤・転移の手助けをさせます。
私たちは、腸管に良性のポリープを発症するマウスや悪性の大腸がんを発症するマウスモデル、肺がんのマウスモデルなどを用いて、がん微小環境の多彩な細 胞やそれらに関連するシグナル伝達経路が、がんの悪性化に果たす役割について詳細に研究しています。大腸がんについては、JNK/mTORC1経路(原著論文Fujishita 2011、総説・著書Fujishita 2009、Aoki 2017)・MEK/ERK経路(原著論文Fujishita 2015)・EGFR経路(原著論文Sakuma 2012)・Wnt経路・Hedgehog経路の役割(原著論文 Arimura 2009、総説・著書 Aoki 2011)、自然免疫系(原著論文Kajino 2020、トピック2022年10月参照)・腸内細菌・低酸素環境の役割、内分泌・代謝調節(原著論文Kojima 2019、トピック2020年12月参照)の役割を解明することを目指して研究を展開しています。さらに、大腸がんの薬剤抵抗性獲得における微小環境の役割の解明(原著論文 Fujishita 2017、トピック2019年7月参照)、デスモイド腫瘍マウスモデルの作出にも取り組んでいます。
2)転移の分子メカニズムの解明
大腸がんによる死因の約9割が転移によるものであるとされます。しかしながら、転移の分子メカニズムは十分に解明されておらず、治療標的となる分子の同定も遅れています。浸潤・転移は、生体内で(1)局所浸潤、(2)脈管侵入、(3)脈管内輸送、(4)管外遊出、(5)微小転移巣形成、(6)転移増殖の6つの連続した生物学的プロセスを経ますが、この浸潤・転移プロセスの進行は、転移促進因子と転移抑制因子が複雑に相互作用することにより制御されると考えられています。
私たちは、レンチウイルスshRNAライブラリーを用いたスクリーニング法(A)と、トランスポゾンを用いたスクリーニング法(B)を用いて、大腸がんの転移を制御する因子を、生体での機能に基づいて同定し、それらの治療標的としての妥当性を検証する研究を行っています。shRNAライブラリーを用いた手法では、HNRNPLLという新規大腸がん転移抑制因子を同定し、大腸がん細胞の上皮間葉転換の際にHNRNPLLの発現が低下することでCD44の選択的スプライシングに変化が生じ、CD44v6というバリアントが産生されて浸潤能が亢進することを見出しました(原著論文Sakuma 2018、トピック2017年8月参照)。

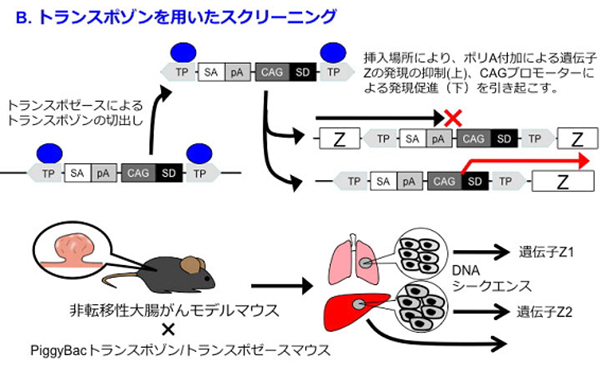
3)がん悪液質の病態生理の解明
悪液質は、骨格筋や脂肪組織の萎縮による進行性の体重減少を主徴とする症候群で、進行がん患者の約80%に発症し、がん患者の約20%の直接死因と推定されています。しかしながら、悪液質の病態生理は未だに不明であり、有効な早期診断法や治療法も存在しません。私たちは、がん悪液質を、がんが原因となって肝臓・筋肉・脂肪組織などを含む多臓器間の連環が撹乱されて種々の代謝異常をきたした病態であるととらえ、ヒトの悪液質に非常によく似た病態を示す大腸がんマウスモデルを用いた解析により悪液質発症の原因をつきとめ、治療標的となる分子を同定する研究に取り組んでいます。
トピックス
スタッフ紹介
業績
リサーチレジデント募集
生体レベルでのがん研究に興味のある方、当分野では名古屋大学大学院医学研究科、あるいは名古屋市立大学大学院薬学研究科の連携大学院生として研究することが可能です。

