がん標的治療トランスレーショナルリサーチ分野
概要
Cell Reports Medicine誌 2025年9月号にKRAS阻害薬と免疫微小環境への影響に関する論文が掲載されました
長らくUndruggableとされてきたKRASタンパクですが、創薬技術の進歩によりKRAS G12C阻害薬が2021年に本邦でも承認され、肺がん患者さんに使用されています。当分野ではKRAS G12C阻害薬の初期・獲得耐性に上皮間葉移行(EMT)が関係することを報告していましたが(Clinical Cancer Res 2020)、EMTがKRASG12C阻害薬投与ご早期より惹起されることを明らかにしました。
また、膜タンパクの局在の変化はYAPの核移行を誘導し、YAPの下流でRASスーパーファミリーのひとつであるMRASの発現を誘導することで、KRAS G12C阻害薬のadaptive resistanceを示すことを明らかにしました(Nature Cancer 2023)。
当研究室では、新たにKRAS阻害剤が免疫環境におよぼす影響を明らかにしました。本研究では、(1)KRAS阻害剤ががん細胞におけるCD47の発現を誘導すること(CD47はマクロファージによるがん細胞の貪食(ファゴサイトーシス)を抑制することが知られています)、(2)KRAS阻害剤と抗CD47抗体を併用することで、マクロファージのファゴサイトーシスを再賦活化し、さらにファゴサイトーシスを行うマクロファージにおけるPD-L1の発現が増大することを見出しました。これらの結果を踏まえ、(3)KRAS阻害剤/抗CD47抗体/抗PD-L1抗体の3剤を併用することで大きく治療効果が改善することを明らかにしました。
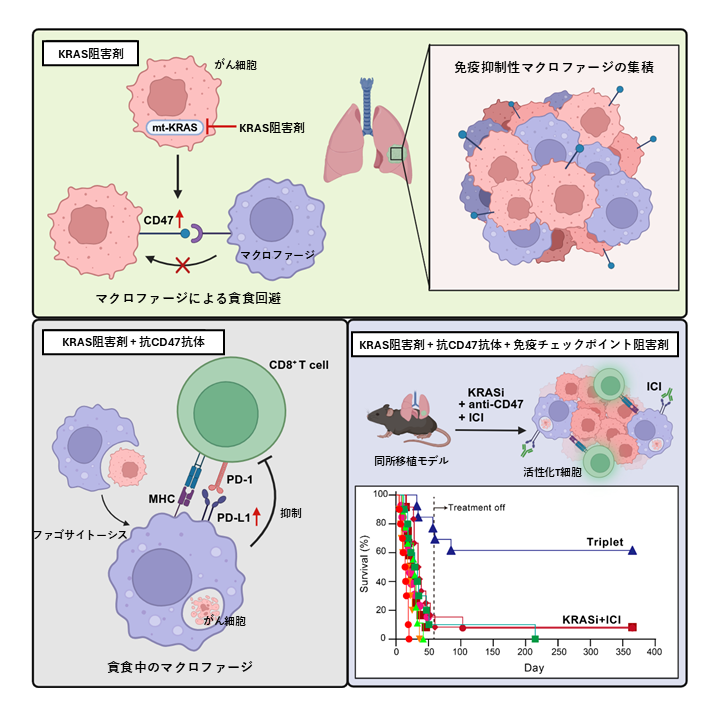
こちらから、Cell Reports Medicine誌に掲載された論文を閲覧することが可能です。
当分野の研究領域
- RAS/RAF変異腫瘍に対する新規治療開発
- ctDNA・全エクソームシーケンス・トランスクリプトーム解析を融合した大腸がんのサブタイプ分類とタイプ別の治療法の開発
がんの薬物療法は、がん細胞の特性を標的とした分子標的治療が導入され、この20年余りで大きく変化しましたが、いまだに創薬が困難なものが存在します。その代表例が全がんの20%程度に変異を認めるKRASに対する創薬です。2021年、KRAS変異の一部(KRAS変異にはいくつか種類があり、そのうちの一種類)に対する薬剤が承認され、KRAS変異腫瘍に対する治療開発は大きく変わろうとしています。我々は、KRAS阻害薬をどの患者さんにどのように使用するべきか、がん細胞×モデル動物×患者検体の検討を組み合わせ明らかにしようとしています。
また、がん細胞は、分子標的薬を長期間使用すると、薬に耐性を示すことが知られています。耐性機序の解明と新たな治療法の提唱も当分野の重要な柱です。
最後に、がん細胞から血液中に漏れ出た、血中循環DNA(circulating tumor DNA, ctDNA)について、我々は国立がん研究センターを中心とした大腸がんの5000例を超える大規模臨床試験から得られたctDNAと腫瘍を解析しています。これにより、ctDNAの新たな評価法の開発を目指しています。
目指すもの
がんの20%に認められるKRAS変異腫瘍に対し、分子標的治療法を提唱することが一つです。また、現在臨床現場で使用されている分子標的薬について「効く人」と「効かない人」を見分け、効かない人に対して新たな治療を見つけることも目指しています。
ctDNA研究については、様々な臨床医・研究者と一緒に、大腸がんの再発予測、治療開発に役立つ発見をすることが目的です。
連絡先
愛知県がんセンター研究所
がん標的治療トランスレーショナルリサーチ分野 分野長
衣斐 寛倫(えび ひろみち)
〒464-8681 名古屋市千種区鹿子殿1-1
Tel:052-762-6111(内線)7060
E-mail:hebi@aichi-cc.jp
研究内容 一般の方へ
研究活動の概要
我々のひとつひとつの細胞には、20000~30000個の遺伝子が存在し、細胞が規則正しく機能を発揮するようにプログラムされています。この遺伝子に傷が入ると、細胞は無秩序に増え、がんを発症します。患者さんのがん細胞のゲノム(遺伝子)を調べ、がん細胞が増殖する原因分子を標的に、それぞれに対応する薬剤を投与する治療法は分子標的治療と呼ばれています。最近では、人の免疫ががん細胞に対し正常に働くように促す免疫チェックポイント阻害薬のような分子標的薬も登場しています。
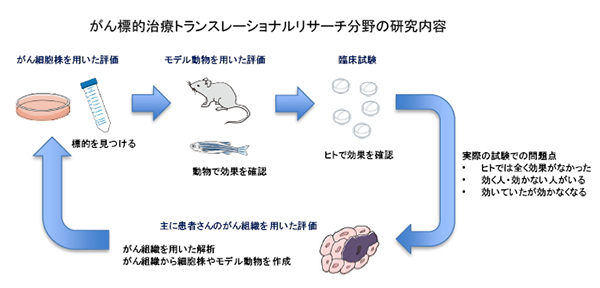
しかし、これらの治療薬は細胞やマウスで効果が認められても、ヒトの臨床試験では思うような効果が得られず患者さんに薬を届けられないケースや、標的薬が効かなくなり(耐性になり)その後の治療がうまくいかないケースも多く見受けられます。当研究室では、がん細胞×モデル動物×患者検体を三位一体となって解析することで、新たな治療の標的の発見や、現在ある治療をより効果的にする方法の開発を行っています。
研究テーマ紹介
がんは、健康な人の細胞の中にある遺伝子の情報に異常が起きることで発生します。従ってがん細胞は、もともと正常だった我々の細胞が変化して発生したものです。感染症は異物(菌やウイルス)によって起きるため、ヒトが持たないタンパク質や機能などをターゲットとして治療することができますが、がんの場合、正常細胞にはなくがん細胞だけが持っている異常を見つけ治療薬を開発しなければならず、容易ではありません。
そのような中でも、近年、がん細胞の生存と増殖に関わる異常をターゲットとして治療を行う分子標的治療薬が開発されるようになりました。我々の研究室でもそのようながんに特徴的な異常を見つけることが目的の一つです。
分子標的薬は様々ながんの治療に用いられていますが、いまだに創薬が困難なものが存在します。その代表例がKRAS変異です。がんの20%程度に認められるとされていますが、有効な薬ができていませんでした。2021年、いくつかあるKRAS変異の一種に対する薬剤が承認され、KARS変異腫瘍に対する治療開発は大きく変わろうとしています。我々はKARS阻害薬をどの患者さんにどのように使用するべきか、比較的実験がしやすい細胞株を用いた実験から異常を発見し、動物モデルで検証し、最終的にはがん患者さんで臨床効果を検証することを目指しています。
一方で、人間の体は複雑なため、細胞やモデル動物で効果があっても、人の臨床試験では効果を認めないことも多くあります。「効く人」と「効かない人」がいて「なぜ効かないのか」「どうやったら効くようになるのか」を解明するのが本研究室のもう一つの目的です。このため、病院の各部署と協力して、患者さんのがん組織を解析し、患者さんの治療経過と照らし合わせたりしています。このような検討を行うには、患者さんのがん組織そのものを使用する必要が出てきます。協力に同意いただけた患者さんのがん組織から細胞を取り出したり、モデル動物に移植したりすることで、治療効果を再現する試みも行っています。
分子標的治療薬は、がん細胞が増えていくのに重要な場所をブロックし細胞を死滅させる治療です。しかし、がん細胞は様々な方法を使ってそこから逃れようとします。これには、(1)がん細胞が持つ別の機能を使って増殖を続け薬が効かなくなる、(2)がん細胞に新たな異常が発生し薬が効かなくなる、の2つの可能性が存在します。我々は、これまでにがんにおけるこれらの仕組みを解析することで治療効果が改善できることを示してきました。
最後に、がん細胞から血液中に漏れ出た、血中循環DNA(circulating tumor DNA, ctDNA)について、我々は国立がん研究センターを中心とした大腸がんの5000例を超える大規模臨床試験から得られたctDNAと腫瘍を解析しています。これにより、ctDNAの新たな評価法の開発を目指しています。
研究成果
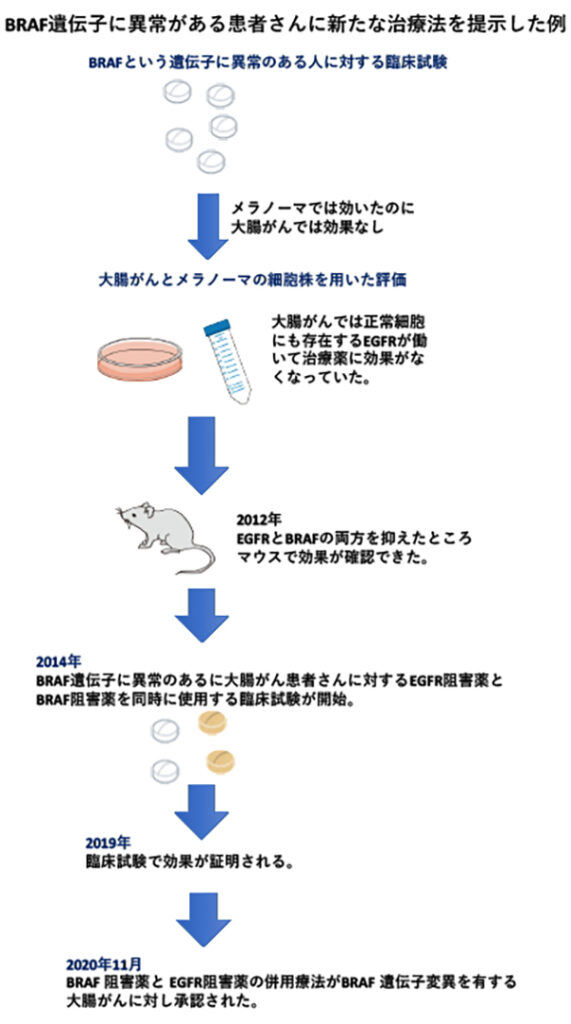
細胞の増殖を促す指令を伝えるBRAFという遺伝子に異常が起きると、がんが発生し、がん細胞が増殖することが知られています。しかしながら、BRAFの働きを抑え、がん細胞の増殖にストップをかけるBRAF阻害薬は、皮膚がんの一種であるメラノーマには有効でしたが、大腸がんに対しては無効でした。我々は、大腸がんではBRAFに加えてEGFRというタンパクが細胞の増殖に関わっており、両者を抑えることでBRAF遺伝子異常による大腸がんを治療できることを示しました。EGFR阻害薬とBRAF阻害薬は臨床試験でも有効性が示され、2020年に保険治療となっています。
目指すもの
患者さん個々人のがんに合わせた分子標的薬の開発が進む中で、当分野では治療薬が「効く人」と「効かない人」を見分け、効かない人に対し、新たな治療法を見つけ、より治療成果を上げていくことを目指しています。
研究内容 専門家の方へ
当研究室で対象としているのは、固形腫瘍、特に肺がん・消化器がんである。臨床上問題となっている事柄を対象とするため、必ずしも一つの分子の異常にこだわることなく、広く研究を行っている。以下にKRAS変異腫瘍に対する新規治療開発を当研究室のトランスレーショナルリサーチの例として紹介する。
MAPKシグナル変異腫瘍に対する新規治療開発
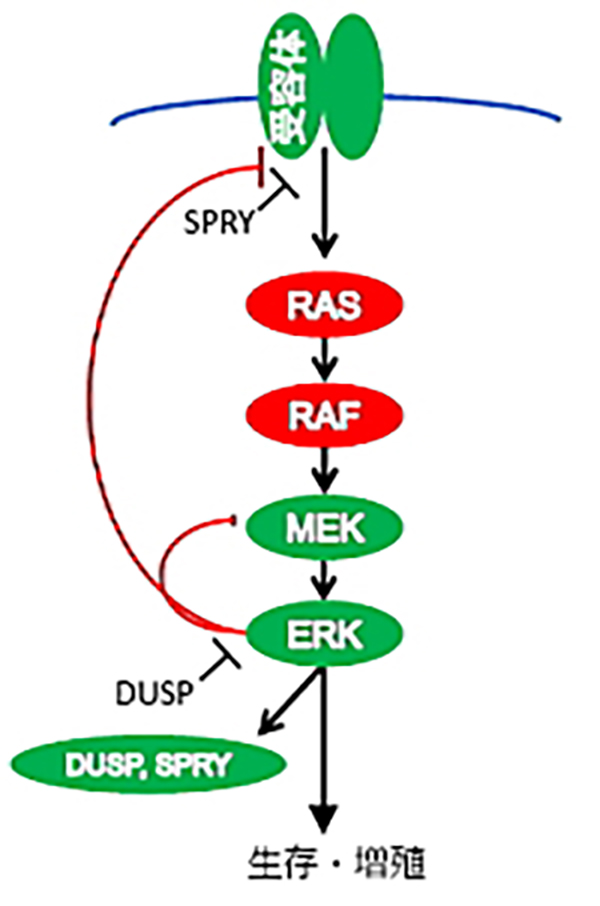
MAPKシグナルは、細胞外の様々な刺激を核内へと伝える主要なシグナル伝達系の一つである。MAPKシグナルの活性は様々なフィードバック機構により一定に調節されている一方で、遺伝子異常により活性が亢進すると正常細胞の形質転換(がん化)をもたらす。
我々の研究グループではMAPKシグナルのフィードバック機構に着目しMAPKシグナル変異腫瘍(KRAS変異がん、BRAF変異がん)に対する新規治療を提唱してきた。
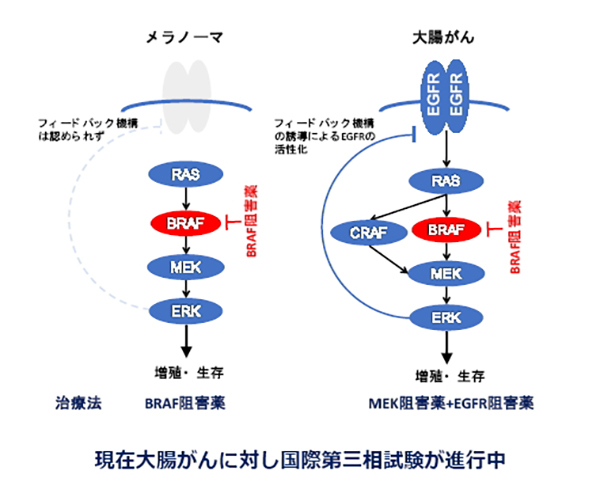
BRAF変異大腸がんに対するEGFR阻害薬+MEK阻害薬併用療法
BRAF阻害薬はBRAF変異メラノーマに対し有効であるが、BRAF変異大腸がんには無効である。我々はBRAF変異大腸がんにおいて、BRAF阻害によるMAPKシグナルの抑制がフィードバック機構を誘導することによりEGFRを活性化し、その結果MAPKシグナルを再活性化することを示した。BRAF阻害薬とEGFR阻害薬の併用は、MAPKシグナルを完全に遮断し、腫瘍細胞にアポトーシスを誘導し、マウス腫瘍を縮小する。本併用療法は現在第三相試験が進行中である。
(Corcoran RB*, Ebi H, et al. Cancer Discovery 2012. *Co-first author)
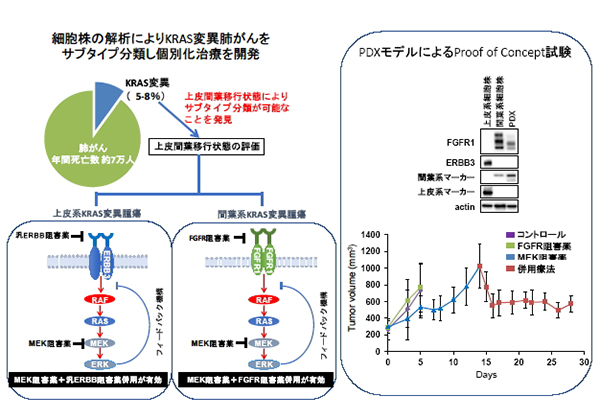
KRAS変異肺がんに対する新規治療開発
KRAS変異は肺がん・膵がん・大腸がんなどの難治がんで高頻度に認める変異であるが、直接阻害薬の開発が難しく有効な治療法に乏しい。また、変異KRASの下流に存在するMEKの阻害薬は単剤では十分な効果を示さないことが知られている。我々はKRAS変異肺がんが、上皮間葉移行により2つのサブタイプに分類されることを示した。またMEK阻害薬はフィードバック機構により受容体を活性化するが、活性化される受容体は上皮間葉移行状態に依存しており、上皮系腫瘍ではERBB3、間葉系腫瘍ではFGFR1が活性化していた。それぞれの阻害薬とMEK阻害薬の併用療法は患者由来ゼノグラフトモデル(PDX)で効果を示し、上皮間葉移行状態を指標としたKRAS変異肺がんの個別化医療が考えられた。
(Kitai H et al. Cancer Discovery 2016)
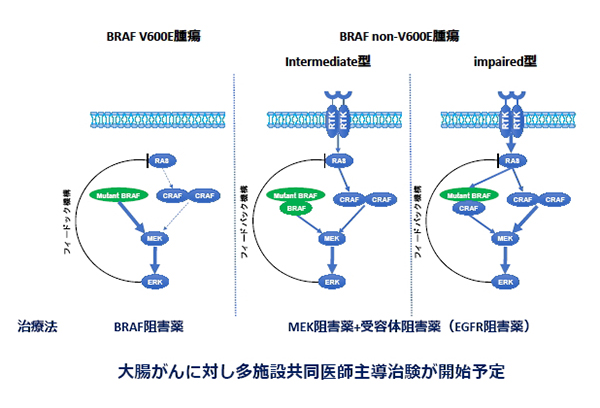
BRAF non-V600E腫瘍に対する新規治療開発
BRAF変異にはホットスポット変異であるV600Eと、V600周囲の活性化ループ(A-loop)近辺、もしくは464-469番目のアミノ酸が構成するphosphate-binding loop(P-loop)に生じるnon-V600E変異が存在する。BRAF non-V600変異には部位によりBRAFキナーゼ活性が数倍~50倍程度上昇するもの(intermediate型)と、活性がむしろ低下するもの(impaired型)が存在する。BRAF阻害薬はV600変異に対する特異的阻害薬のため、BRAF non-V600変異腫瘍には無効であり、BRAF non-V600E変異腫瘍に対しては下流シグナルであるMEKの阻害薬が検討されている。我々は肺がん、大腸がんにおいて、MEK阻害がフィードバック機構を誘導し受容体キナーゼ(主にEGFR)の活性化をきたすことを示した。これらの知見をもとにBRAF non-V600E変異大腸がんに対し、EGFR阻害薬・BRAF阻害薬・MEK阻害薬の三剤併用療法の医師主導治験が開始予定である。
(Kotani H et al. Oncogene 2018)
スタッフ紹介
業績
リサーチレジデント募集
研究員・博士研究員・大学院生を募集します。現在、当研究室では(1)RAS-RAFシグナルに異常を示す腫瘍に対する新規治療開発、(2)大腸がんに対する大規模臨床検体を用いたTR研究を行っています。
RAS-RAF研究については、これまでにFDA承認を得た併用療法の提唱や医師主導治験のProof of Concept を示した研究を行っています(Cancer Discovery 2012, 2016.Clinical Cancer Research 2018, 2019, 2020, Oncogene 2018, etc)。現在、変異KRASの直接阻害薬が開発されKRAS G12C阻害薬がFDA承認されるなど、今後注目の領域です。当グループではKRAS G12C阻害薬の感受性・獲得耐性因子をいち早く報告しています(Clinical Cancer Research 2020、Nature Cancer 2023、Cell Reports Medicine 2025)。
大腸がんに対する大規模臨床検体を用いた研究については、根治的外科治療を予定している大腸がん患者さん約5,200 名を対象に、患者さん毎にがん由来の遺伝子異常を同定し、患者さん個々の遺伝子パネルを作製後、定期的に血液を採取(liquid biopsy)して、その遺伝子異常が存在するか調べる試験(CIRCULATE-JAPAN)のTR研究を行っています。検体についてはすべて保管してあることから、豊富な臨床情報が紐づいた検体研究をできる貴重な機会と考えています。
ご興味のある方は、衣斐寛倫(hebi@aichi-cc.jp)までご連絡ください。

