分子腫瘍学分野
概要
悪性新生物の発生と転移の分子病因として関わる分子を明らかとして、それを応用するうえで必要とされる基盤情報の構築に関する研究を行っています。現在は主に、悪性中皮腫の原因遺伝子と診断・治療開発に関わる研究を行っています。

分子腫瘍学分野ではヒト固形腫瘍の発がん・進展・転移機構を分子レベルで解明し、新たな診断法や分子標的治療法に応用可能な分子・遺伝子を同定する研究を行っています。研究の中心となっている悪性中皮腫は、アスベスト曝露後の長期の潜伏期ののち、胸膜や腹膜に発生する極めて難治性の腫瘍です。日本における新規の患者数は約1500名と稀な腫瘍で、この治療に関わる研究者や医療従事者は、頻度の高い肺がんや消化器がんに比べて圧倒的に少なく、治療法の開発が遅れています。既存の分子標的薬はほとんど効果をみせず、近年、新たに承認された免疫チェックポイント阻害剤も全ての患者さんに対して十分な有効性を示すわけではありません。患者さんから頂いた臨床検体や、検体から樹立した細胞株、また実験動物モデルを用いて、悪性中皮腫細胞に生じた遺伝子の異常をもとに、診断や新たな治療法開発の研究を進めています。常勤スタッフの他に名古屋大学を始めとする各大学からの任意研修生およびレジデントが研究に携わっています。
目指すもの
私たちの研究室は、悪性中皮腫細胞の基礎研究では国内外をリードする研究室として認められています。悪性中皮腫のゲノム異常では、NF2遺伝子やLATS2遺伝子といった特徴的ながん抑制遺伝子の変異を世界で初めて発表してきました。さらに、患者さんから提供を頂いた検体から細胞株を樹立し、現在30株を超えており、国内外の多くの中皮腫研究グループも活用しています。今後も、悪性中皮腫に対する新たな治療標的分子の探索や治療法の開発を目指して研究を続けていきたいと考えています。
連絡先
愛知県がんセンター研究所
分子腫瘍学分野 分野長
関戸 好孝(せきど よしたか)
〒464-8681 名古屋市千種区鹿子殿1-1
Tel:052-762-6111(内線)7070
E-mail:ysekido@aichi-cc.jp
研究内容 一般の方へ
研究活動の概要
悪性腫瘍は、複数の鍵となる遺伝子の異常が積み重なって発症することがわかってきました。がん細胞では、細胞の増殖のアクセル役となる「がん遺伝子」や、ブレーキの役の「がん抑制遺伝子」が変異しているため、細胞の増殖が止まらなくなっています。
分子腫瘍学分野では、アスベストによって生じる悪性中皮腫や、肺がん、脳腫瘍といった難治性のがんに関する遺伝子解析を行っています。がんが発生し、悪化、転移する仕組みを分子レベルで解明することで、診断や治療の標的となる新たな分子や遺伝子を特定することに力を注いでいます。患者さんから提供されたがん細胞や、それをもとにがん細胞が増殖を続ける状態を獲得した細胞株、また実験用のマウスを用いた実験が中心です。常勤スタッフのほかに名古屋大学をはじめとする各大学からの研修生やレジデントが研究に携わっています。
研究テーマ
1)悪性中皮腫の発症に関わる「Hippoシグナル伝達系」の解明
悪性中皮腫はアスベストにさらされると、約30年の潜伏期を経て発症する治療が難しい悪性腫瘍です。現在、日本では年間およそ1500人の新たな患者さんが報告されています。悪性中皮腫は診断が確定したときにはすでに進行していることが多く、根治的な外科手術を受けられる患者さんは極めて限られます。通常の抗がん剤や放射線治療が効きにくい上に、がん細胞の増殖に関わる原因分子にピンポイントで働きかけ、他のがんでは治療成績を上げている「分子標的薬」も有効な効果を示していないのが現状です。一方で、最近は「免疫チェックポイント阻害薬」による新たな治療法が登場しました。これは免疫細胞の働きががんにより抑えられるのを阻害する薬で、一部効果も報告されていますが、まだ全ての悪性中皮腫患者さんに有効性を示すまでに至っていません。
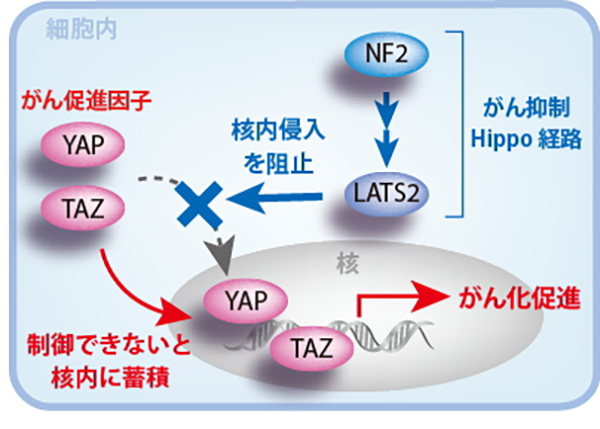
私たちの研究室では、患者さんから提供されたがん細胞から「細胞株」を作ることに長年取り組んできました。細胞株の遺伝子を解析することで新たながん関連遺伝子を特定し、悪性中皮腫の新しい診断法や分子標的治療法を開発することを目指しています。この研究を通し、私たちは細胞内のLATS2(ラッツ・ツー)遺伝子ががんの増殖を抑える「がん抑制遺伝子」であることを発見しました。このLATS2は別の遺伝子NF2と連携して「Hippo(ヒッポ)シグナル伝達系」を形成し、がん細胞の増殖や悪化を抑制するシグナルを伝える役割を果たしています。悪性中皮腫の患者さんのうち、半数ちかくの腫瘍でNF2遺伝子に変異が見られ、患者さんの60-70%でこのHippoシグナル伝達系が正常に機能せず、がんを促進する因子にストップをかけられない状態にあることをつきとめました。現在、私たちの研究室ではHippoシグナル伝達系の異常で活性化してしまうがん促進因子に対する治療薬の共同開発にも参画し、成果を上げています。
2)「合成致死」戦略による新たな治療法
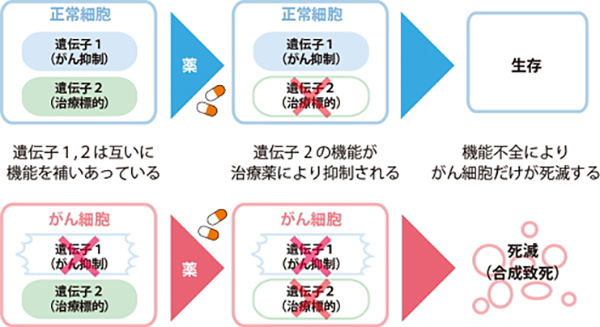
従来の抗がん剤は、がん細胞だけでなく、正常細胞の増殖も抑えてしまうことから、様々な副作用が生じて患者さんへの負担が大きく、治療の妨げとなります。また、悪性中皮腫で変異を起こしている遺伝子はほとんどが「がん抑制遺伝子」で、治療の直接のターゲットにすることは困難です。そこで「合成致死」という戦略を用いて、正常細胞にはほとんど影響を与えず、がん細胞だけに効く薬の開発を模索しています。「合成致死」とは、がん細胞の中で、変異しがんを抑制する機能を失った遺伝子1(下図参照)に対し、本来その働きを補うはずの正常な遺伝子2をあえてノックダウンすることで、がん細胞を死滅させてしまうという考え方です。この場合、正常な細胞の遺伝子2をノックダウンしてしまっても、その働きを遺伝子1が補うため、副作用などの大きな障害が起こりません。この治療戦略は遺伝性乳がんの治療で大きな効果を上げています。悪性中皮腫においても、遺伝子1・2のような組み合わせを発見し、新たな治療法につなげられるよう研究を重ねています。
目指すもの
遺伝子の異常の積み重なりによりできた悪性腫瘍は極めて多様性に富み、生体内の様々な状況下に適応し増殖を続ける組織です。そのため、抗がん剤や分子標的治療薬からすり抜け、薬に対する抵抗性を獲得すると考えられています。こうした複雑ながん細胞の本質を明らかにするために、私たちは正常な細胞が変異を起こす分化異常のメカニズムや、がん細胞の増殖に関係するシグナル伝達系の異常、がん細胞とその周りの組織も含むがん微小環境の果たす役割など様々な視点から研究しています。私たちはこれらのアプローチにより、治療の標的となりうる分子の特定や、その分子を起点とした新たな診断法の開発に取り組んでいきたいと考えています。
研究内容 専門家の方へ
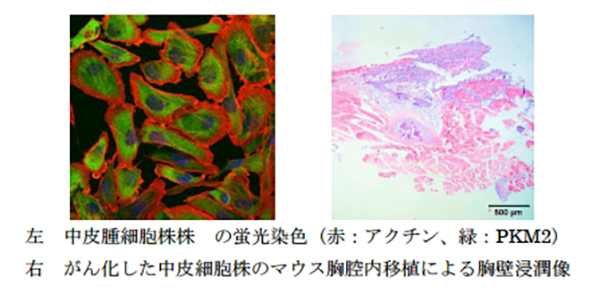
1)悪性中皮腫の新規細胞株の樹立・開発
私達のグループでは悪性中皮腫の細胞株の樹立に長年取り組んできました。現在、30株以上の日本人悪性胸膜中皮腫患者由来の細胞株を樹立し、様々なin vitro実験、マウス移植(xenograft)によるin vivo実験を行っています。
2)悪性中皮腫におけるHippoシグナル伝達系異常の解明
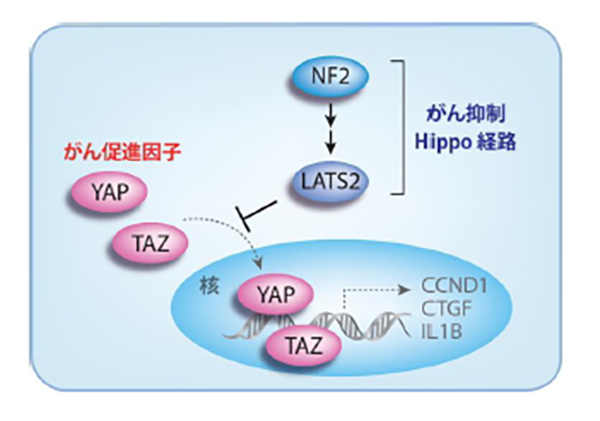
悪性中皮腫では、がん抑制遺伝子の1つである NF2(神経線維腫症2型の原因遺伝子)に高頻度の変異が見られることを当研究分野で明らかにしています。また、NF2遺伝子産物(merlin、マーリン)によって活性化するLATS2やその他因子の遺伝子にも変異が見られることを見出しています。これら一連の因子が伝達する経路は 「Hippo(ヒッポ)シグナル伝達系」 と呼ばれ、この経路の異常はYAPおよびTAZという転写コアクチベータ(がん促進因子)を活性化させることで、悪性中皮腫の発症を誘導すると考えられています。YAPやTAZの恒常的な活性化によりCCDN1(サイクリンD1)、CTGF(結合組織成長因子)、IL1Bといった細胞周期や成長因子、サイトカインが、恒常的に転写が亢進していることを明らかにしてきました。
3)悪性中皮腫治療薬の効果を予測するマーカーの発見
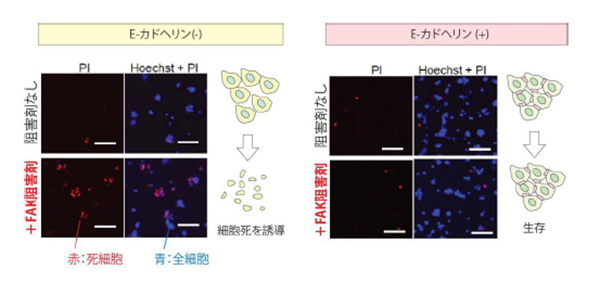
私たちは悪性中皮腫の治療効果が期待されているFAK(Focal adhesion kinase)阻害剤について、その有効性を検討しました。その結果、NF2遺伝子に変異を持つ悪性中皮腫細胞のうち、E-カドヘリンというタンパク質を持たない細胞に対してFAK阻害剤が顕著な効果を示すことを明らかにしました。E-カドヘリンは悪性中皮腫に対するFAK阻害剤の治療効果を予測するバイオマーカーとなりうると期待されます。
4)合成致死性を利用した分子標的薬の開発
悪性中皮腫で高頻度に変異している遺伝子はCDKN2A, BAP1, NF2, TP53です。いずれもがん抑制遺伝子であり、治療の直接的な標的とすることは非常に困難です。他のがん種では、活性型のがん遺伝子変異(チロシンキナーゼ)をターゲットとした分子標的薬がよく用いられますが、悪性中皮腫ではこれらの遺伝子に変異が見つかることは稀であることから、全く別のコンセプトによる新規治療薬の開発が求められています。
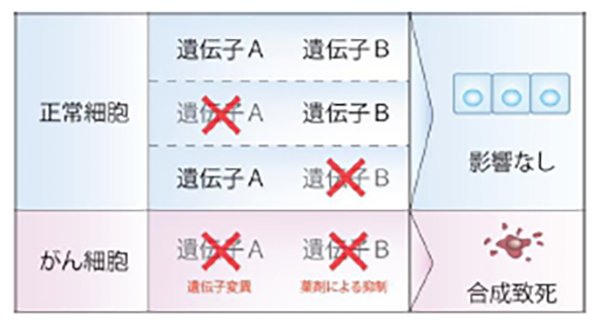
正常細胞では、ある遺伝子Aが機能しなくても、遺伝子Bがその機能を補てんすることで、細胞が正常に機能することがあります。しかし、遺伝子Aに加えて遺伝子Bの機能まで抑制されると、細胞は正常に機能できず死に至ります。これを「合成致死」と呼びます。悪性中皮腫細胞では、すでにNF2などの一部の遺伝子に変異があり、機能していません。そこで、合成致死を誘導できるような遺伝子Bを見つけ、その機能を薬剤で抑制できれば、がん細胞だけを攻撃する理想的な抗がん剤となることが期待できます。私たちは現在、合成致死性を利用した新しい分子標的薬の探索に取り組んでいます。
5)悪性中皮腫のゲノム異常と代謝・細胞特性の包括的理解による新規分子標的の同定
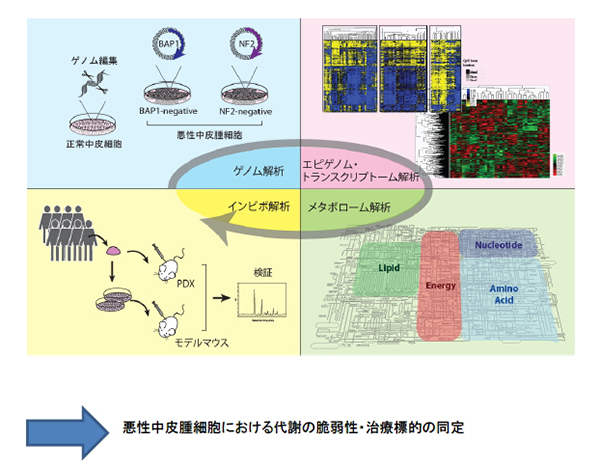
我々のグループは、悪性中皮腫のドライバー変異はがん抑制遺伝子が主体であることを明らかにしてきました。さらに、悪性中皮腫細胞はしばしば広範な染色体欠失を呈することも大きな特徴です。これらのゲノム異常は悪性中皮腫細胞における特徴的な代謝リプログラミングを引き起こすことが考えられ、代謝の”脆弱性”が生じることが強く予想されます。さらに、中皮細胞がもともと有する細胞特性、例えば”アノイキス抵抗性”や”上皮間葉転換(EMT)”の易移行性などが、ゲノム異常によって増強されるのではないかと考えています。
我々が樹立した悪性中皮腫細胞株を用い、網羅的な解析により、悪性中皮腫における新規の治療標的を同定したいと考えています。
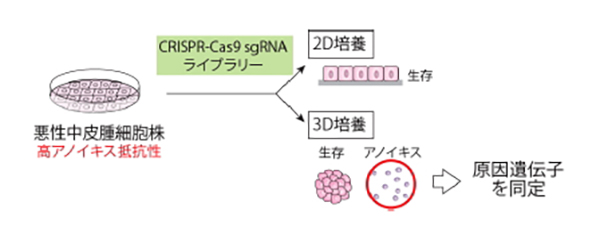
図の解説:高アノイキス抵抗性の悪性中皮腫細胞株を用い、CRISPR-Cas9sgRNAライブラリーを感染させ、2D培養と3D培養の違いからアノイキスに関係する遺伝子を同定します。悪性中皮腫に特徴的なアノイキス抵抗性の原因遺伝子に対する治療戦略が開発されるものと期待されます。
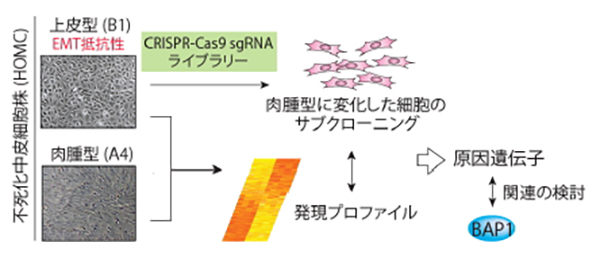
図の解説:私達が樹立した不死化中皮細胞株HOMCには上皮型(B1)と肉腫型(A4)の形態を示すものがあります。CRISPR-Cas9sgRNAライブラリーによるスクリーニングや発現プロファイルの検討により、EMT易移行性の原因遺伝子を同定します。さらに、BAP1遺伝子の変異は上皮型の悪性中皮腫に高頻度に見られることから、その関連性を検討することにより悪性中皮腫におけるBAP1遺伝子変異の組織型による頻度差の原因を明らかにできるのではないかと考えています。

