分子遺伝学分野
概要
研究活動の概要
2018年より始動したばかりの分子遺伝学分野では、がん細胞に後天的に生じた様々な遺伝子変化を指標に、新規がん関連遺伝子とその変化の同定、機能解析、介入法探索を行うとともに、がんの不均一性を考慮して治療効果や再発を予測する分子マーカーやその検出法の開発を行っています。また、がん予防医療研究領域の2分野と協力して、生殖細胞系列での遺伝要因による発がんリスクを低リスク要因から高リスク要因(いわゆる遺伝性腫瘍症候群の原因遺伝子)まで連続的に捉え、がん発症リスクを予測して予防に繋げるプログラムの開発と社会実装の研究を行っています。
目指すもの
がんの体細胞変化に着目した研究では、ゲノムDNAからシグナル伝達などのパスウェイまで様々な階層での変化に着目し、がん細胞の表現型形成におけるそれらの意義を解明し、新たな診断マーカーや治療法の開発につなげ、がんの克服に貢献していきます。 がんの生殖細胞系列変化に着目した研究では、疾患発症リスクの予測に資するゲノム・エピゲノム変化の同定、リスクの評価とそのフィードバック法の開発、リスクに基づく介入による予防法開発などにより、がんの予防に貢献していきます。
研究内容 一般の方へ
それぞれのテーマ別に、どのような成果が得られるのかを、過去の成果を具体例としてお示しします。
1)あたらしいがん関連遺伝子(がん促進遺伝子やがん抑制遺伝子)を発見し、その働きや詳しい仕組みを明らかにします。
肺腺がんの早期から不活性化される新規がん抑制遺伝子の発見
肺腺がん手術組織を用いた解析から、喫煙者・非喫煙者に関らず早期にDNAメチル化と呼ばれる変化ががん特異的におこる遺伝子を複数見いだし、その中から高頻度にDNAメチル化によって不活性化される新たながん抑制遺伝子としてTRIM58を同定しました。TRIM58を肺腺がん細胞に強制的に発現させるとがん細胞の増殖や腫瘍の形成が抑えられ、TRIM58のがん抑制機能が確認されました。また、TRIM58の発現量がDNAメチル化により減少すると、細胞と細胞の間や細胞と間質との間の結合を調節する遺伝子群の量が変化し、がん発生初期にみられる組織構造の崩壊の原因になっている可能性が示されました。これらの結果は、TRIM58のメチル化が喫煙の有無に関らず肺腺がんの早期診断マーカーになりうる可能性や、TRIM58の細胞内機能を補完できる分子や薬剤を特定することで肺腺がんに有効な治療薬の開発ができる可能性を示しています。
2)がんの再発や治療効果の予測、ならびに治療法選択に役立つ、血漿を使ったがん遺伝子解析(リキッドバイオプシー)など体に優しい検査法を開発します。
胃がんをリアルタイムで監視する時代へ―EBウィルス関連胃がんを血液で検出する
胃がんの約一割の症例で認められるEpstein-Barrウィルス(EBウイルス、EBV)感染胃がん(EBV関連胃がん)では、特定の分子標的薬が効果を示す可能性のある遺伝子の変化が高率に検出されることから、EBVが治療選択の重要な分子マーカーになると考えられます。現在は手術時に摘出されたがん組織を用いてEBV感染の有無が診断できますが、がんの薬物治療中や再発時にがん組織をとることは侵襲が大きいために実際に検査が行われることは稀です。そこで、循環血液中の遊離DNAを検出するリキッドバイオプシー(液体生検)技術を用い、胃がんのEBV感染を採血だけで検出する方法を開発しました。本研究成果により、血液により治療効果の予測・判定や再発の監視などをリアルタイムにかつ低侵襲に行えるようになるため、今後の胃がん診断に有用なツールとして期待できます。
【参考ページ:国立研究開発法人 日本医療研究開発機構ホームページ】
胃がんをリアルタイムで監視する時代へ―EBウィルス関連胃がんを血液で検出する手法に関する研究論文の掲載―
3)日本人における遺伝性のがんの原因遺伝子の変化とがんの発症リスクとの関係を明らかにします。
国内における遺伝性卵巣がんの割合とその特徴を解明-個人の発がんリスクに基づくゲノム予防・医療実現の基本情報を明らかに-
卵巣がんの患者数は、世界的に増加傾向にありますが、早期発見が困難なことから、発症リスクが高い人を特定して予防策を立てることができれば、死亡数の低下が見込まれます。日本人の卵巣がん230例の患者から研究のために提供された血液DNAを用いて、日本で初めて系統的に、生まれた時から持っている(生殖細胞系列といいます)遺伝性卵巣がん関連遺伝子のがんになりやすい変化の有無を調べました。その結果、41名(17.8%)の患者に11遺伝子の変異を見出しました。この中には、遺伝性乳がん卵巣がん症候群の原因遺伝子であるBRCA1(19例、8.3%)、BRCA2(8例、3.5%)や大腸がんなどを発症しやすいリンチ症候群の原因遺伝子(6例、2.6%)の変異が含まれました。これらの変異を持つ人は、(1)若年で卵巣がんと診断された、(2)血縁者に卵巣がん患者がいる、(3)高異型度漿液性腺がんと呼ばれる型の卵巣がんにかかっている、などの特徴がありました。このような特徴をもつ人は、自身や血縁者の診療の際に遺伝カウンセリングでリスクの評価や遺伝子検査を行い、予防策をたてることで健康を維持できる可能性があり、発症による死亡率の減少が期待されます。
【参考ページ:慶応義塾ホームページ】
国内における遺伝性卵巣がんの割合とその特徴を解明 [PDFファイル/460KB]
研究内容 専門家の方へ
1)がんのゲノム・エピゲノム・トランスクリプトーム異常を指標とした新規がん関連遺伝子の同定と機能解析
マイクロアレイや次世代シーケンサーを用いたゲノム・エピゲノム・トランスクリプトーム解析により検出したゲノムの一次構造(点変異やコピー数)や機能(DNAメチル化や遺伝子発現)異常を指標に、がんの発生や進展に関与する遺伝子とその異常を同定します。同定した遺伝子異常に関しては、臨床検体を用いた予後との関連など臨床病理学的意義の解明や機能解析による生物学的な意義の解明を行い、診断マーカーや治療標的としての可能性を検討します。最近では、早期肺腺がんの網羅的メチル化解析の結果、早期から著明なメチル化により発現抑制を受けるTRIM58(Kajiura et al., 2017)、あるいは食道扁平上皮がんの進行に伴いタンパク発現パターンが変化するRNA結合タンパクTIA-1やKHSRP(Hamada et al., 2017; Fujita et al., 2017, 下図参照)を同定し報告しています。これらは、京都府立医科大学の消化器外科や徳島大学の胸部・内分泌・腫瘍外科、婦人科との共同研究で実施しています。さらに、大規模な公的なデータベースを活用した探索や再現性の迅速な検討(Kohmoto et al., 未発表データ)、ゲノム編集を用いた変異の機能的アノーテーション付け(Mitsui et al., 2016)をはじめとする機能解析などにより、がんの診断や治療に役立つ確度の高い候補遺伝子異常の同定パイプラインを構築しています。
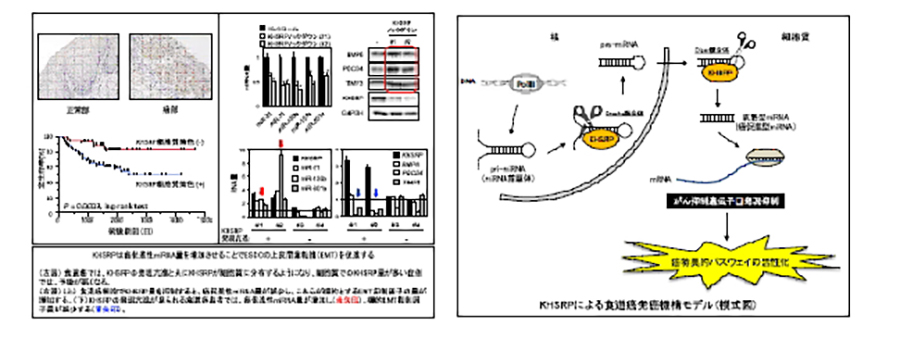
2)がんの不均一性を考慮した診断法開発および稀少がんや難治性がんの治療標的探索
リアルタイムPCRやデジタルPCR、質量分析計、次世代シーケンサーなどを用いたがんにおける定量的変異解析を行うことで、時間的、空間的な不均一性の評価とその技術的・臨床的意義の検討を行っています。検体としては、生検や手術標本だけでなく血漿中セルフリーDNA(cfDNA)も対象としており、新規診断法開発も目指しています。最近では、cfDNAを用いた胃がん症例でのHER2(ERBB2)遺伝子増幅の低侵襲的高精度検出法を開発し、治療効果判定や再発のモニターだけでなく、手術時からの再発時抗HER2抗体療法の効果予測など適応症例の絞り込みにも有用である可能性が示されました(Shoda et al., 2017; Shoda et al., 2017)。また、EBウイルス感染胃がん(EBV関連胃がん)を対象に、血漿中cfDNA中のEBVを検出することで治療効果判定や再発のモニターが可能な系も開発しています(Shoda et al., 2017, 下図参照)。さらに、術前放射線化学療法を行なった大腸がんを対象に、治療前生検と治療後手術検体のシーケンスを行うと、治療による腫瘍の治療効果が病理学的に低い場合でもKRASやBRAFの変異が消退あるいは出現することがあり、治療介入によりクローンの交代が生じている可能性が見出されています(藤田ら, 未発表データ)。このことは、リアルタイムなゲノム解析により、その時点で腫瘍に最適な治療の選択が行える可能性を示しています。これらは、京都府立医科大学の消化器外科との共同研究で実施しています。
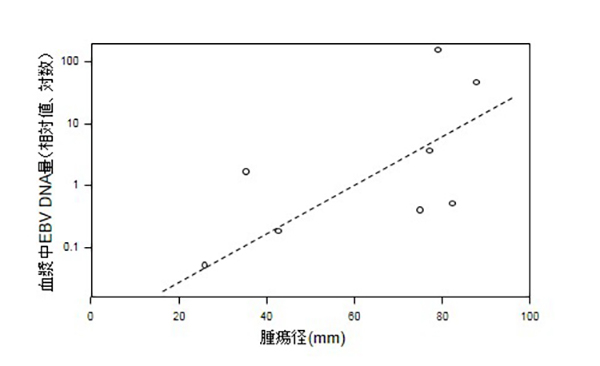
図1の解説:血漿中に流れるがん細胞由来EBV DNA量を定量的に検出することで、体内に存在するEBウイルス関連胃癌細胞の量を安全で高感度に推定できる可能性がある。
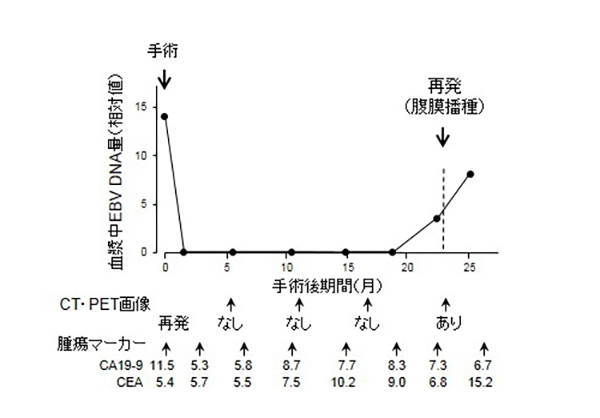
図2の解説:手術前に血液でEBV DNAが検出されていた症例で、手術後に一旦EBV DNAが消失した後、その他の検査で再発が見つかる以前に血中でEBV DNAが検出された。
また、これまでドライバー変異が不明な稀少がんや有効な治療標的が見つかっていない難治性がんの有効な治療法探索を目的に、ゲノム・エピゲノム異常を探索しています(Kajiura, et al., 2017; Kohmoto et al., 2017)。これらは、徳島大学の胸部・内分泌・腫瘍外科や京都府立医科大学の消化器外科との共同研究で実施しています。
3)発がんリスクに関する分子遺伝学的研究
分野長の井本は中央病院リスク評価センターのセンター長を兼任しており、遺伝診療として遺伝カウンセリングを行なっています。この中では、遺伝性腫瘍症候群が疑われる患者さんやそのご家族のリスクを家系図聴取や生殖細胞系列での遺伝子検査で評価しています。一方で、遺伝性腫瘍症候群の原因遺伝子の我が国における変異の頻度やがん発症の浸透率などは多くが不明です。遺伝性腫瘍症候群の原因遺伝子の変異の解析、がん化に至る上での他の遺伝因子や環境因子との関連、生物学的意義が不明な多様体(Variants)の意義付けを行なっています(Hirasawa et al., 2017; Matsudate et al., 2017; Morita et al., 2015)。これらは、慶應大学の産婦人科や徳島大学の産婦人科、皮膚科、愛知県がんセンター研究所がん予防研究分野、がん情報・対策研究分野との共同研究で実施しています。
また、愛知県がんセンター研究所がん予防研究分野、がん情報・対策研究分野における各種のがんのリスク予測研究に協力して、遺伝要因・環境要因による発がんリスク予測とこれに基づく介入方法とその効果に関する研究を行っています。
スタッフ紹介
業績
リサーチレジデント募集
一緒に研究して頂ける研究員及びリサーチレジデントの方を募集しております。ご興味のある方はぜひお問い合わせください。

