分子診断トランスレーショナルリサーチ分野
概要
分子診断トランスレーショナルリサーチ分野は、田口分野長が2018年9月に米国MDアンダーソンがんセンターから帰国して立ち上げた新しい研究室です。当分野では、ヒトやマウスの血液、腫瘍組織、がん細胞株など、様々な生体材料を用いて統合的オミクス解析を行い、新規バイオマーカーや治療標的の探索同定、さらにその臨床応用まで幅広い研究を展開しています。特にプロテオミクスに重点を置いており、革新的なプロテオーム解析技術の開発からプロテオミクスの新時代を切り拓こうとしています。また、私たちは、トランスレーショナルリサーチを標榜する研究室として、医療を実践していく上で最も重要な問題に、科学的なアプローチを用いて真正面から取り組むことを重視しています。熱意のある諸君の参加を心待ちにしています。

目指すもの
私たちは、主に次の2つの重要な研究テーマに取り組み、がん診断・治療の革新を目指しています。
- がんの早期発見・治療個別化に有用な血液バイオマーカーの同定
- 網羅的分子プロファイリングによるがんの分子病態の解明と新規治療標的分子の同定
連絡先
愛知県がんセンター研究所
分子診断トランスレーショナルリサーチ分野 分野長
田口 歩(たぐち あゆむ)
〒464-8681 名古屋市千種区鹿子殿1-1
Tel:052-762-6111(内線)7040
E-mail:a.taguchi@aichi-cc.jp
研究内容 一般の方へ
研究活動の概要
分子診断トランスレーショナルリサーチ分野では、ヒトやマウスの血液や手術で取り除いたがん組織、がん細胞が試験管内で半永久的に増殖を続けるがん細胞株など、様々な生体材料を用いて、タンパク質(プロテオミクス※)を中心に大規模な分子解析を行っています。その結果をもとに、早期診断や治療効果の予測につながる新しいバイオマーカー※や、治療の標的となる分子の特定、それらを実際の治療に生かすまでの幅広い研究を展開しています。がん治療の最前線を担う愛知県がんセンター病院との緊密な連携を強みとして、実際にがん治療を進めるうえでの問題点や疑問点を研究の課題として設定する、また反対に基礎研究から得られた成果を治療の現場に還元するという、研究所と病院の架け橋となるような研究(トランスレーショナルリサーチ)を強力に進めているのが私たちの研究室の特長です。基礎から臨床まで多様なバックグラウンドを持つ研究者が、消化器がん、肺がんなどの難治がんを標的に、がんの克服という大きな目標に向かって、一丸となって突き進んでいます。
プロテオミクス
DNAにふくまれる遺伝子はタンパク質の設計図です。DNAから遺伝子情報がRNAに写し取られ(転写)、RNAの配列情報に基づいて、タンパク質が合成されます(翻訳)。ヒトの体には、約10万種類のタンパク質があるといわれています。タンパク質は、私たちの体の構造をつくったり、体のさまざまな機能を果たしたりしていますが、図1のように、タンパク質にはDNAやRNAを調べるだけではわからないことがたくさんあります。プロテオミクスとは、タンパク質(プロテイン)の大規模なデータ(プロテオーム)を研究することです。
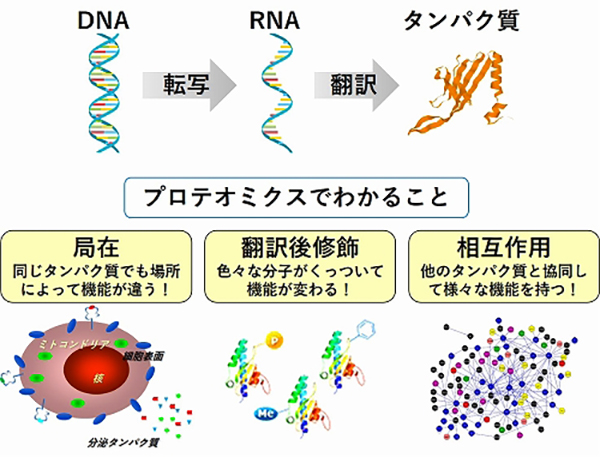
バイオマーカー
血液や尿などの体液や組織に含まれるタンパク質やDNAなど生体内の物質で、病気の変化や治療に対する反応に相関し、指標となるものを指します。バイオマーカーの量を測定することで、病気の有無や進行度、治療効果の指標の1つとすることができます。
研究テーマ紹介
がんによる死亡者数は年々増加しており、1981年より日本人の死因のトップ(約30%)となっています。私たちはどのようにがんと闘い、克服していけばよいのでしょうか。
1)精度の高い「早期診断」を実現する血液診断テストの開発
がんになるリスクの高い病変や、手術で取りきることができる早期のがんを見つけて治療する「早期診断、早期治療」はがんを克服する有望な手段です。様々ながんの中でも胃、大腸、肺、乳、子宮頸がんは検診による早期発見が有効ながんです。
ただし、検診にも次のような問題点があります。
- がんが見つけにくい場所にある、わかりにくい形をしているなど、がんを見逃してしまう「偽陰性」
- 検診でがんの疑いと判定されても、多くの場合はがんではないため不必要な精密検査を受けることになってしまう「偽陽性」
- がんの中にも進行が非常に遅いものや、進行がんにならない悪性度の低いがんがあるにもかかわらず、区別がつかないために通常のがんと同じように検査や治療がおこなわれてしまう「過剰診断」
などです。
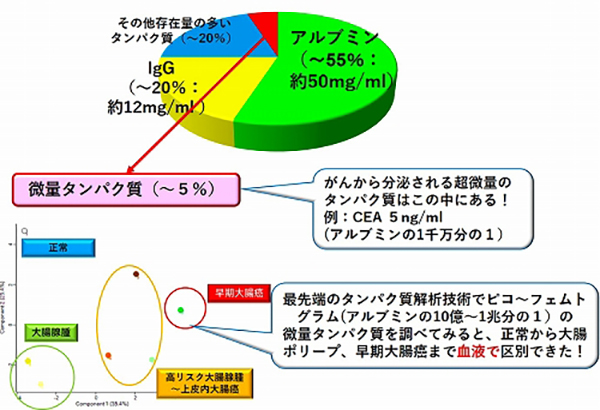
私たちは、内視鏡部、消化器外科部と共同で、大腸がんの早期診断に取り組んでいます。多くの大腸がんは、10年から30年という長い経過の中で、ポリープががん化することで発生します。最初は目に見えないほど小さかったポリープが、がんになるリスクが高い大きなポリープや早期大腸がんまで進行したとしても、ほとんどの場合大腸内視鏡で完全に切除することが可能で、再発する可能性も非常に低いので、大腸ポリープや早期大腸がんを見つけることができれば、大腸がんを克服する大きな一歩になります。
私たちの研究グループが最近開発した、超高感度なタンパク質解析技術で血液を解析してみると、正常と、大腸ポリープ、早期大腸がんまで血液で診断することができることがわかりました(図2)。
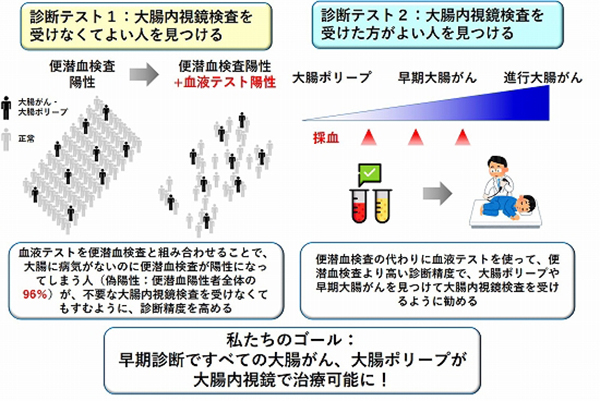
現在、大阪府立大学LAC-SYS研究所と共同で、同定されたバイオマーカーを組み合わせた血液診断テスト(図3)として実用化を目指した研究を進めています。
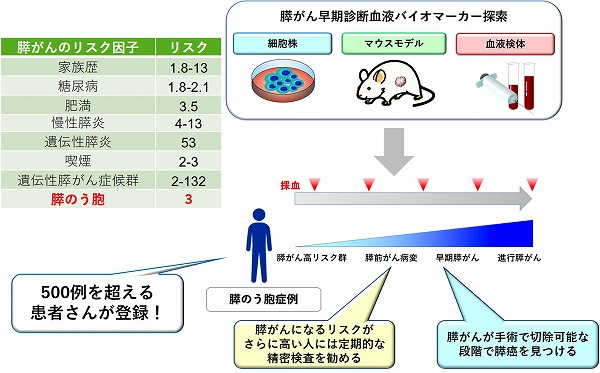
また、私たちは、現在有効な検診が存在しない、膵がんや肝がんなどについても早期診断に役立つ血液テストの研究に取り組んでいます。特に、膵がんは、5年生存率が10%にも満たない極めて予後が悪い難治がんの代表です。さらに膵がんの死亡数はこの30年で8倍以上に増加し、毎年3万人以上が膵がんで亡くなられていますが、最も早期のStage lで手術を受けた膵がん症例の5年生存率は50%を超えていることから、早期診断は膵がんにおいても有効であると考えられます。その一方で、切除可能な膵がんは全体の約15%にとどまり、Stage lで発見される例は全体のわずか2%程度でしかないことから、革新的な膵がん早期診断法の開発が求められています。私たちは、消化器内科部と共同で、膵がんのリスクが高い、膵のう胞症例の長期追跡プログラムを2019年に立ち上げました。現在500例を超える膵のう胞症例が本プログラムに登録されており、定期的に検査を行っていただくと共に、膵がん細胞株や膵がんマウスモデル、また膵がん患者さんの血液を解析して膵がんの早期診断バイオマーカーの探索を行っています(図4)。
2)個別化医療の革新に向けた診断技術の開発
がん患者さん一人一人に合わせて最適な治療を行う、「個別化医療」も近年、がんと闘う有効な手立てとなっています。これまでの医療は、診断された病名が同じであれば、同じ治療法を提供し、医療の質にばらつきをなくすことを目指してきました。しかし、実際に同じ治療をしても、一部の患者さんにはあまり効果がなかったり、副作用が強く出てしまったりすることがあり、必ずしもすべての患者さんが同じ経過をたどるわけではありません。そこで、患者さんのがんの原因や病態を分子レベルで解析し、一人一人の患者さんの状態に合わせて最適な治療をする個別化医療が注目されています。個別化医療では、副作用をできるだけ抑えて、かつ高い治療効果が得られることが期待されます。
私たちは、特に免疫チェックポイント阻害剤の効果や副作用の予測に有用な血液バイオマーカーの探索を行っています。免疫チェックポイント阻害剤はすべての患者さんに有効ではなく、効果が出るのは20%程度の患者さんに限られています。また、免疫チェックポイント阻害剤の副作用としては、免疫反応が過剰になることで起こる、免疫関連有害事象(immune-related adverse event; irAE)と呼ばれる内分泌障害、間質性肺炎、大腸炎、肝炎、腎炎、皮膚障害などが知られています。これらの副作用は免疫チェックポイント阻害剤の量や使用期間と関係なく出現するため予測することは困難である上に、重篤になることもあります。したがって、免疫チェックポイント阻害剤の効果だけでなく、irAEの発症を免疫チェックポイント阻害剤の使用前に予測できるようなバイオマーカーの開発が求められています。
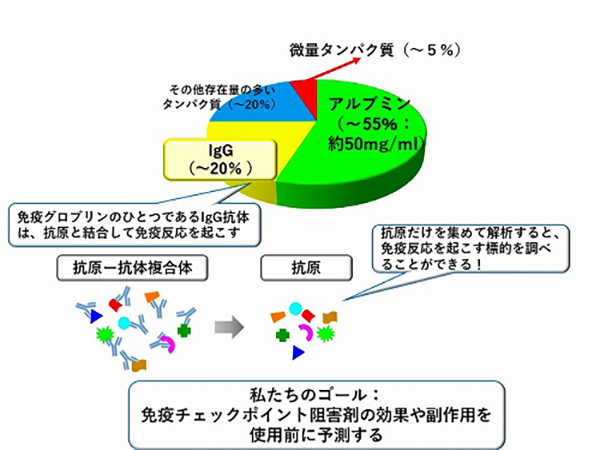
私たちは、血液バイオマーカーの中でも、免疫反応によって血液中に産生される抗体に注目して解析を進めています。抗体に結合した標的となるタンパク質(抗原といいます)を高感度に解析する方法を開発し、免疫チェックポイント阻害剤によって引き起こされる免疫反応と抗原との関連を解析しています(図5)。
3)DNAからタンパク質までの統合的な分子解析による新しい治療法の開発
私たちは、がんの診断だけでなく、新しい治療法の開発にも積極的に取り組んでいます。2019年6月から、がん患者さんの遺伝子を解析し、その結果に基づいて治療内容を決める「がんゲノム医療」が保険適用となりました。しかし、ゲノム解析の結果が実際に治療に結び付く症例は10%程度でしかありません。DNAに存在する遺伝情報がメッセンジャーRNA(mRNA)に読み取られ、タンパク質として合成されますが、その過程で、タンパク質はさまざまな変化を起こします。したがって、多様な機能を持つタンパク質には、遺伝子情報だけではわからない、がん化に大きく関連する要素を含んでいると考えられています。私たちはがん組織やがん細胞株から得られるDNAだけでなく、mRNA、タンパク質までを統合的に解析し、遺伝子の異常だけでなく、がんに起こっている様々なタンパク質の異常を見つけ出すことで、がんのメカニズムを解明し、新しい治療法の開発につなげていきたいと考えています。
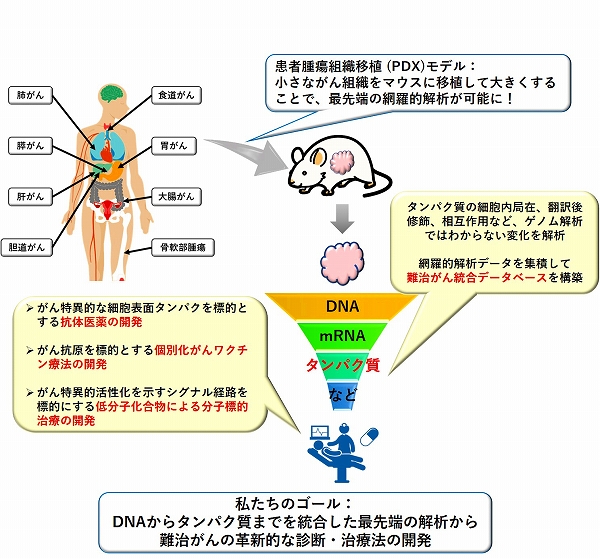
現在、愛知県がんセンターの重点プロジェクトとして、患者さんから生検や手術などによっていただいた少量のがん細胞を直接マウスに移植する、患者腫瘍組織移植(Patient-derived xenografts:PDX)モデルの作成と解析を行っています。PDXモデルによって、今までわずかな検体では調べることのできなかったタンパク質の解析など、様々な最新技術を用いた詳細な分子解析が可能になります。このような取り組みは、世界でも類を見ないものであり、研究所と病院が隣接している愛知県がんセンターの強みを最大限に生かしています。本プロジェクトによって、ゲノム解析だけではわからないような知見が得られ、膵がんや肺がんなど難治がんの新しい診断・治療法の開発につながることが期待できます(図6)。
目指すもの
私たちは、根治可能ながんを見つけることで患者さんの負担や医療コストを減らすことができる早期診断バイオマーカーや、個々の患者さんに合ったがんの最適な治療戦略を立てるための治療個別化バイオマーカー、さらには個別化医療が確立されていない難治がんの新規治療法の開発など、実用化につながる研究に重点をおいて、診断と治療との両輪でがんを克服するための新しい道を切り拓いています。私たちの研究に温かいご支援を賜りますよう、心からお願い申し上げます。
研究内容 専門家の方へ
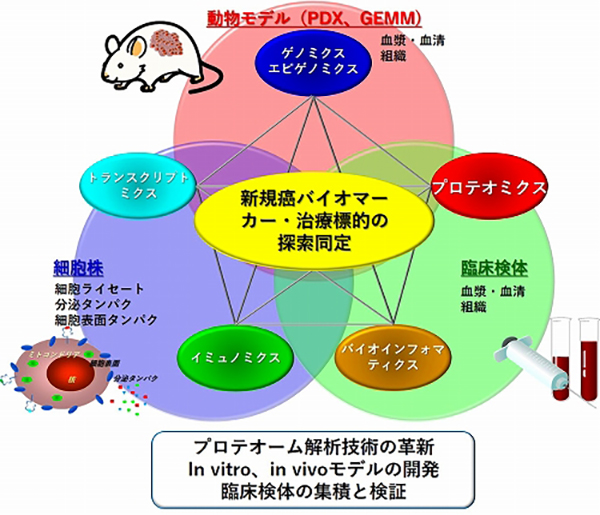
分子診断トランスレーショナルリサーチ分野では、ヒトやマウスの血液、腫瘍組織、がん細胞株など様々な生体材料を用いて、プロテオミクスを始めとしたマルチオミクス解析を行い、消化器がんや肺がんなどの難治がんを標的として、がんの新しい診断法や治療法の開発とその臨床応用を目指した研究を展開しています(図7)。特に、次世代のがん研究を切り拓くプロテオーム解析技術の革新、がんの分子病態を忠実に反映し最先端のオミクス解析を可能にするin vitro、in vivoモデルの開発、社会実装を目指した臨床検体の集積と検証に力を注いでいます。ここでは、主に空間プロテオーム解析について述べますので、血液バイオマーカー研究については、研究テーマ紹介(一般の方向け)もご覧ください。
1)がんの早期診断・個別化医療を目指した血液バイオマーカーの探索
血液中のタンパク質は、簡便かつ低侵襲、低コストで高スループットな診断法となりえることから、がんの早期診断や個別化医療において、大きな期待が寄せられています。
私たちは、血液バイオマーカーの肺がん早期診断における有用性を世界に先駆けて示してきました(Taguchi et al. Cancer Cell 2011; Sin et al. J Clin Oncol 2013; Wikoff et al. J Clin Oncol 2015)。また、この研究を基に、肺がんのリスク評価を高精度に行うことのできる血液診断テストを開発し(Guida et al. JAMA Oncol. 2018)、現在FDA承認を目指した臨床試験を行っています。また、膵がん、大腸がんの早期診断に有用な血中タンパク質バイオマーカーについてもそれぞれ報告しています(Capello et al. JNCI 2017; Fahrman et al. JNCI 2019; Taguchi et al. Cancer Prev Res 2015)。
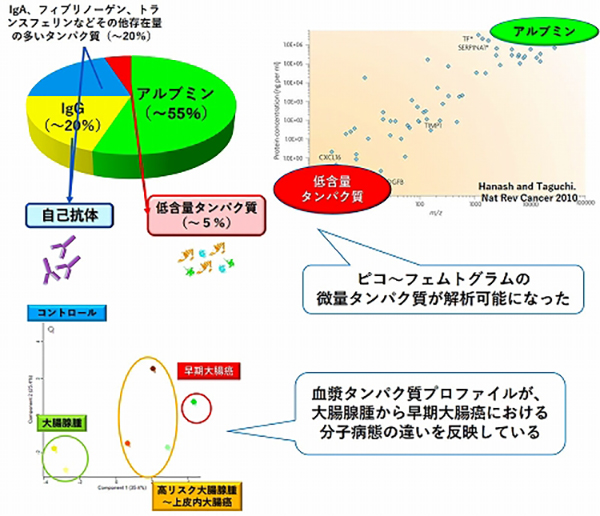
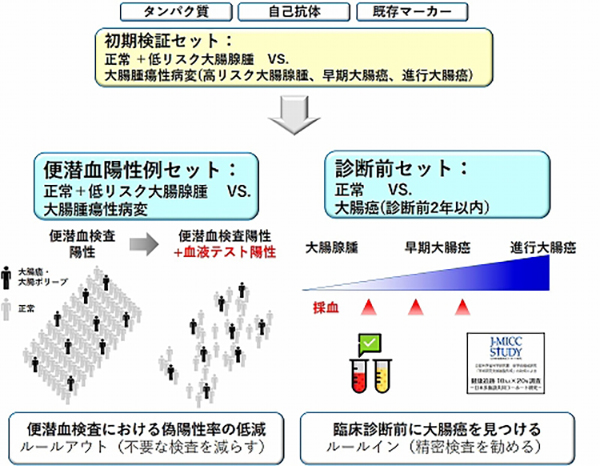
血漿タンパク質の濃度は10の12乗という非常に大きな範囲に広がっていますが、そのほとんどはアルブミン、グロブリンなど20種類程度の非常に量が多いタンパク質であり、がんに関連する微量のタンパク質は全体のわずか5%程度の量しかありません。私たちは、最近、血漿低含量タンパク質画分と抗原―免疫グロブリン複合体画分の超高感度血漿プロテオーム解析を開発しました。これにより、微量ながん関連タンパク質とそれを抗原として認識する自己抗体を同一検体内で詳細に解析できるようになりました。大腸がんにおける血漿低含量タンパク質画分の解析では、800を超える血漿微量タンパク質が実際に定量されました。この血漿微量タンパク質プロファイルの主成分分析を行うと病態に関連したクラスタリングがみられ、血漿タンパク質プロファイルが大腸腺腫から早期大腸がんにおける分子病態の違いを反映していることが明らかになりました(図8)。
現在、血漿プロテオーム解析で同定されたタンパク質バイオマーカーについて、自己抗体やCEAなど既存のバイオマーカーを加えて、内視鏡部、消化器外科部と共同で検証研究に取り組んでいます。本研究では、(1)便潜血陽性例における偽陽性率を低下させて、不要な大腸内視鏡検査を減らす「ルールアウト」と、(2)臨床診断を受ける前の大腸がん症例に対して、精密検査を受けるトリガーとなる「ルールイン」の、2つのバイオマーカーパネルの構築を目指しています(図9)。
2)空間プロテオミクスによるがんの分子病態の解明と新規治療標的分子の探索
私たちは、100を超える代表的なヒトがん細胞株を用いて、細胞ライセート、細胞表面タンパク質、分泌タンパク質の各分画について、高深度かつ網羅的なプロファイリングを行ってきました(空間プロテオミクス)。がん種、遺伝子突然変異に加えて、様々ながんの形質に関連するタンパク質シグネチャの同定と機能的解析を行い、新規がん胎児性抗原であるVCX/Yの肺がんにおける過剰発現(Taguchi et al. Cancer Res. 2014)、イリノテカン感受性を決定するCES2の膵がんにおける過剰発現(Capello et al. JNCI. 2015)、間葉系の形質を示す肺がんにおける分子シグネチャ(Schliekelman et al. Cancer Res. 2015)と免疫プロテアソームの欠損(Tripathi et al. PNAS. 2016)、LKB1不活化を持つ肺腺がんにおけるCPS1の過剰発現とその機能的重要性(Celiktas et al. JNCI. 2017)、変異Krasによって制御されるSyndecan-1を介した膵がんのマクロピノサイトーシス(Yao et al. Nature. 2019)などを報告しています。
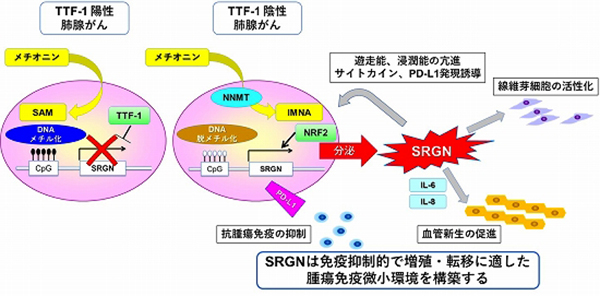
特に最近では、肺腺がんの予後不良なサブタイプであるTTF-1陰性肺腺がんで、SRGNがその高悪性化を促進する重要な因子であることを明らかにしました(Tanaka et al. JNCI 2021; プレスリリース [PDFファイル/476KB])。TTF-1陰性肺腺がんでは、Nicotinamide N-methyltransferase(NNMT)の過剰発現によるメチオニン代謝のリプログラミングが起こっており、DNAメチル化の基質となるS-adenosylmethionine(SAM)が1-methylnicotinamide(1MNA)となってしまうことから、SRGN遺伝子のプロモーター領域に存在するCpGアイランドのDNAメチル化が起こらず、SRGNが過剰発現します。産生されたSRGNタンパク質は、細胞外へ分泌され、CXCL1、IL-6、IL-8などの炎症性サイトカインやPD-L1の制御を介して、肺腺がん細胞そのものの遊走能・浸潤能の亢進や、線維芽細胞や血管内皮細胞の活性化など腫瘍免疫微小環境のリプログラミングを促進し、高悪性度化を引き起こします(図10)。
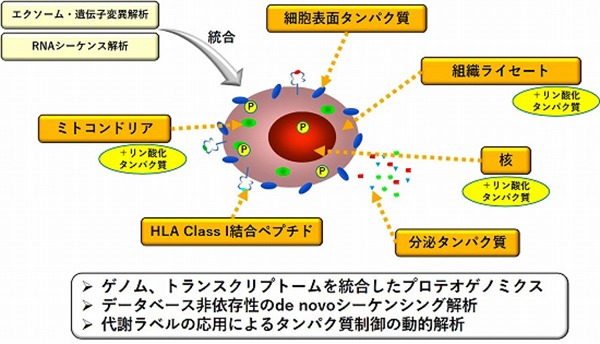
現在は、この空間プロテオミクスをさらに発展させて、ミトコンドリアや核のプロファイリングに加えて、リン酸化を中心とした翻訳後修飾やHLA Class I結合ペプチドの解析を統合的に行っています(図11)。ここでは、遺伝子変異配列を含むネオアンチゲンやlncRNAがコードするマイクロペプチドなど、未知のアミノ酸配列を持つペプチドを同定するために、既存のアミノ酸配列データベースに基づく解析に加えて、各症例のゲノム・トランスクリプトーム情報から構築した症例固有の予測アミノ酸配列データベースに基づくプロテオゲノミクスや、データベース非依存性のMS/MSスペクトルに基づくde novoシーケンシング解析も用いてアミノ酸配列を決定しています。さらに、安定同位体の代謝ラベルを応用することで、タンパク質の産生から分解までにわたる運命制御の空間的、包括的なプロファイリングにも取り組んでいます。
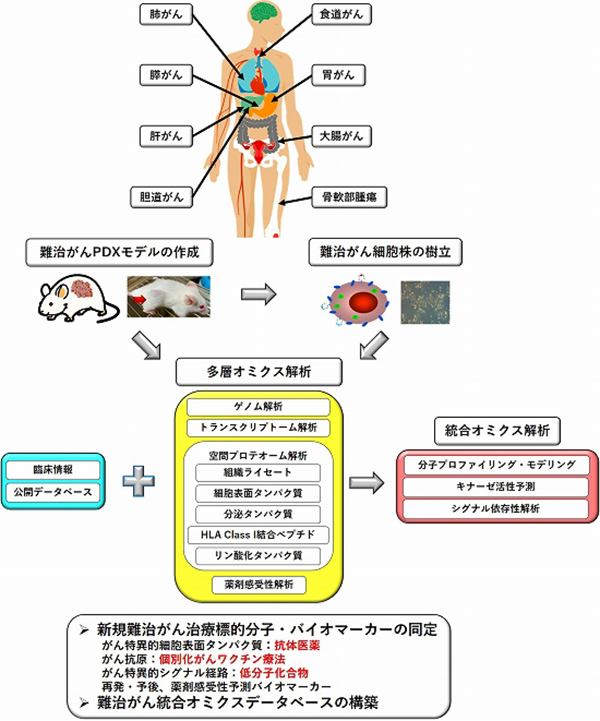
細胞株は、分子生物学的解析において極めて優れたツールではありますが、in vitroでの長期的な培養により元来の腫瘍内における性質や不均一性を失い、実際の腫瘍組織における分子プロファイルを必ずしも反映しない可能性があります。患者腫瘍組織移植(Patient-derived xenografts: PDX)モデルは、ヒトがん組織を非常によく再現する優れたモデルであり、現在、愛知県がんセンターの重点プロジェクトとして、難治がんPDXモデルライブラリの作成と空間プロテオミクスを中心とした分子プロファイリングを行っています。PDXモデルライブラリは特に消化器がんに重点を置いており、その中でも膵がん、大腸がんについては、それぞれ50例を超えるPDXモデルが作成され、国内最大級のライブラリとなっています。また、空間プロテオミクスについては、細胞表面タンパク質、HLA Class I結合ペプチド、リン酸化タンパク質を中心に解析を進めています(図12)。
細胞表面タンパク質は、がんにおいて機能的に重要な役割を果たしているだけでなく、その局在から、直接的な治療標的としても非常に有望であり、実際にFDAに承認されたがん治療薬の約60%が細胞表面タンパク質をターゲットとしています。細胞表面タンパク質は細胞内タンパク質に比べて極めて微量であることから、日常診療において解析に十分な量の腫瘍検体を得る機会はほとんどなく、PDXモデルを作成することで初めて解析が可能になります。腫瘍特異性が高い細胞表面分子が同定されれば、抗体薬物複合体やがん抗原ワクチン、TCR遺伝子導入T細胞輸注療法など、がん免疫療法の革新につながることが期待されます。
がんワクチン療法は、免疫チェックポイント阻害剤との併用など、複合的がん免疫療法の1つとして大きな期待が寄せられています。個別化がんワクチンのターゲットとなるがん抗原は、現在、次世代シーケンサーによるゲノム・トランスクリプトーム情報に基づく変異ペプチド(ネオアンチゲン)として予測同定されていますが、免疫応答を誘導するのは、ネオアンチゲンのごくわずかです。HLA Class I結合ペプチドは、従来のネオアンチゲン予測では同定できない、がん特異的スプライシングに由来するペプチドやマイクロペプチドなどの新規がん抗原を含んでいます。PDXモデルにおいて、プロテオゲノミクスに基づく高感度HLAクラスI分子結合ペプチド(HLAリガンドーム)解析を行うことで、今まで同定できなかった未知のペプチドを含む抗原ペプチドを高感度・高精度に捉えることが可能になり、より効果の高い、個別化がんワクチン療法への道を拓くことが期待できます。
タンパク質のリン酸化によるシグナル伝達をターゲットとして、低分子化合物を中心に分子標的治療が開発されています。特にチロシンキナーゼはがんで重要な役割を果していますが、通常のリン酸化プロテオーム解析(IMAC法によるリン酸化ペプチド濃縮法)では、存在量の少ないチロシンリン酸化修飾は、全体の1%程度しか同定できません。私たちは、リン酸化チロシン抗体によるリン酸化ペプチド濃縮を組み合わせることで、同定されたリン酸化修飾部位全体の5%超にあたる1,000個を超えるチロシンリン酸化修飾情報を取得できる、網羅的リン酸化プロテオーム解析を開発しました。また、リン酸化プロテオームデータから上流キナーゼを予測するキナーゼ活性プロファイリングを行うことで、がん特異的に活性化された新規シグナル経路の同定と創薬が期待できます。
3)最後に
私たちは、革新的なプロテオーム解析技術の開発から、がんの早期発見・治療個別化に有用な血液バイオマーカーの同定や、分子プロファイリングによるがんの分子病態の解明と新規治療標的分子の同定に取り組んでいます。国内外の多数の研究機関と共同研究を行っておりますので、私たちの研究に興味のある方は、ぜひお気軽にご連絡ください。
スタッフ紹介
過去メンバー
- 田中一大(ポストドクトラルフェロー)2014-2017(現所属:名古屋大学大学院医学系研究科呼吸器内科 病院助教)
- Rekha Jain(ポストドクトラルフェロー)2016-2018(現所属:Marwadi University、Assistant Professor)
- Delphine Dayde(ポストドクトラルフェロー)2016-2018(現所属:Inserm, Dr. Rodolphe Fischmeister’s lab, Postdoctoral Fellow)
- Mei Chee Tai(ポストドクトラルフェロー)2016-2018(現所属:Cancer Research Malaysia, Postdoctoral Researcher)
- 加藤毅人(ポストドクトラルフェロー)2018(現所属:名古屋大学大学院医学系研究科呼吸器外科 病院助教)
- Xiaoyi Shi(修士課程)2018-2019(現所属:Max Planck Institute of Experimental Medicine, Dr. Luis Pardo’s lab, Ph.D. Graduate Student)
- Behnoush Khaledian(博士課程)2018-2019(現所属:藤田医科大学医学部生化学 助教)
- Yuwen Du(博士課程)2018-2021
- 森 治樹(滋賀医科大学外科)2019-2021(現所属:滋賀医科大学医学部附属病院 腫瘍センター 特任助教)
- 水野和幸(名古屋大学大学院医学系研究科消化器内科)2019-2021(現所属:名古屋大学医学部附属病院 化学療法部 病院助教)
- 阿部雄一(主任研究員)2019-2024 岐阜大学 糖鎖生命コア研究所分子科学研究センター戦略推進室 特任准教授
業績
リサーチレジデント募集
現在、常勤研究員、任意研究生を募集しております。出身学部は問いません。また、名古屋大学大学院医学系研究科の連携大学院生(先端がん診断学、博士課程・修士課程)も募集しております。
当分野では、がんの本質の解明から近い将来の臨床応用を目指したトランスレーショナルリサーチに、多様なバックグラウンドを持つメンバーが取り組んでいます。最先端のプロテオーム解析技術を応用した分子プロファイリングや血液バイオマーカー研究に興味のある方、とにかくがんの克服に貢献したいという熱意のある方は、ぜひお気軽に田口(a.taguchi@aichi-cc.jp)までご連絡ください。

