腫瘍免疫応答研究分野
概要
免疫細胞ががん細胞を認識し、攻撃する仕組み(がん免疫)を詳しく調べて解明する研究をしています。また、がん免疫を人為的に制御して治療に応用するがん免疫療法や、がん免疫を強める治療薬の開発研究をしています。

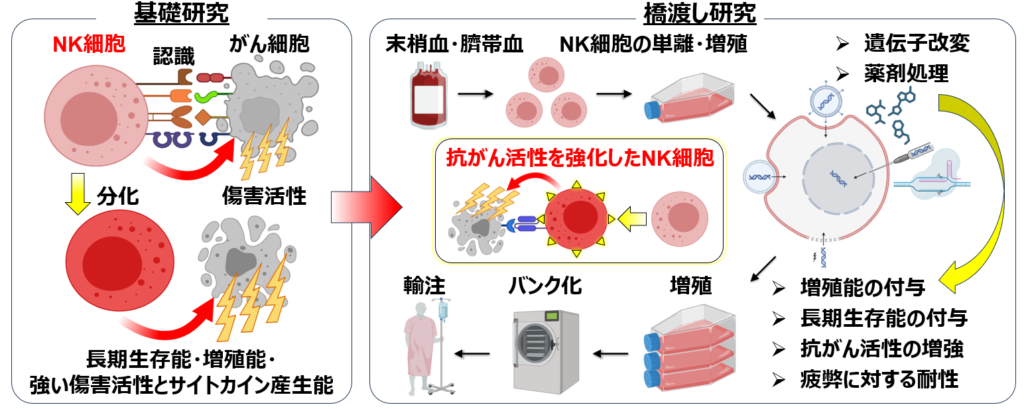
腫瘍免疫応答研究分野では、ナチュラルキラー(NK)細胞という免疫細胞のがん免疫の研究を中心に進めています。がん免疫の研究や免疫療法の開発は、T細胞という免疫細胞を中心に進められています。しかし、現在のがん免疫療法の治療効果は十分ではなく、完治に至るがんの種類は限られています。従って、T細胞以外のがん免疫にかかわる免疫細胞の機能を強化するような、新しい免疫療法の開発が必要です。NK細胞は、T細胞が排除できないがん細胞を攻撃して排除できるという特性を持つことから、次世代の免疫療法の開発にとって有用だと考えられています。しかし現在、NK細胞のがん免疫を強化する治療法は確立されていません。私たちは、NK細胞の研究によってがんの撲滅に貢献したいと考えています。そのために、まずは、NK細胞ががん細胞と出会い、排除すべきものと捉え(認識し)、がんを攻撃できるようになり(活性化し)、攻撃し(細胞傷害活性を示し)、性質を変化させ(分化し)、死滅する(細胞死する)までの一連の現象を分子レベルで解明し、NK細胞をより深く理解するための基礎研究をしています。その上で、基礎研究を通して得た知見を活かし、NK細胞によるがん免疫を強化する薬剤の探索や、遺伝子改変NK細胞を利用したがん免疫療法の研究開発や橋渡し研究を通して、NK細胞を利用してがんを完治できるような免疫療法の開発を目標としています。
目指すもの
NK細胞を利用し、がんを完治できる免疫療法の開発を目指します。この目標を達成するために、NK細胞によるがん免疫の本態を分子レベルで理解するための基礎研究を基盤とし、その上にNK細胞のがん免疫を人為的に増強する橋渡し研究を構築していきます。
連絡先
腫瘍免疫応答研究分野 分野長
鍋倉 宰(なべくら つかさ)
〒464-8681 名古屋市千種区鹿子殿1-1
Tel:052-762-6111(内線)7020
E-mail:t.nabekura@aichi-cc.jp
研究内容 一般の方へ
研究活動の概要
私たちの体内には、がんを排除する免疫細胞としてNK細胞とT細胞が存在しています。これらの免疫細胞ががん細胞を認識し、活性化した後、がん細胞を殺して排除する仕組み(がん免疫)を解明することで、がん免疫を強化して、より効果的な治療法や薬を開発することを目指しています。腫瘍免疫応答研究分野ではがん免疫を担う免疫細胞のうち、特にNK細胞によるがん免疫の研究を中心に進めています。現在のがんに対する免疫療法の開発研究は、T細胞を中心に進められています。しかし、現行のがん免疫療法の治療効果は十分ではなく、完治できるがんの種類は限られています。また、現在の免疫療法は時に重篤な副作用が発生します。従って、より安全で治療効果が高い、新しい免疫療法の開発が必要不可欠です。NK細胞は、T細胞が排除できないがん細胞を攻撃して排除できるという特性を持っていることから、次世代の免疫療法の開発にとって有用だと考えられます。しかしながら、これまでにNK細胞の機能を強める薬剤や治療法は確立されていません。私たちは、NK細胞の研究を通して、がんの撲滅に貢献することを最終目標としています。従って、まずは、NK細胞ががん細胞を認識し、攻撃するまでの一連の仕組みを分子レベルで解明し、より深く理解するための基礎研究をしています。その上で、基礎研究を通して得た知見を活かし、NK細胞によるがん免疫を強化する薬剤やNK細胞を利用したがん免疫療法の開発研究や橋渡し研究をしています。その後、臨床試験を経て新しい治療法の安全性と有効性を確認し、最終的にはNK細胞によってがんを完治する治療法を提供することを目標としています。
研究テーマ
(1)NK細胞とは
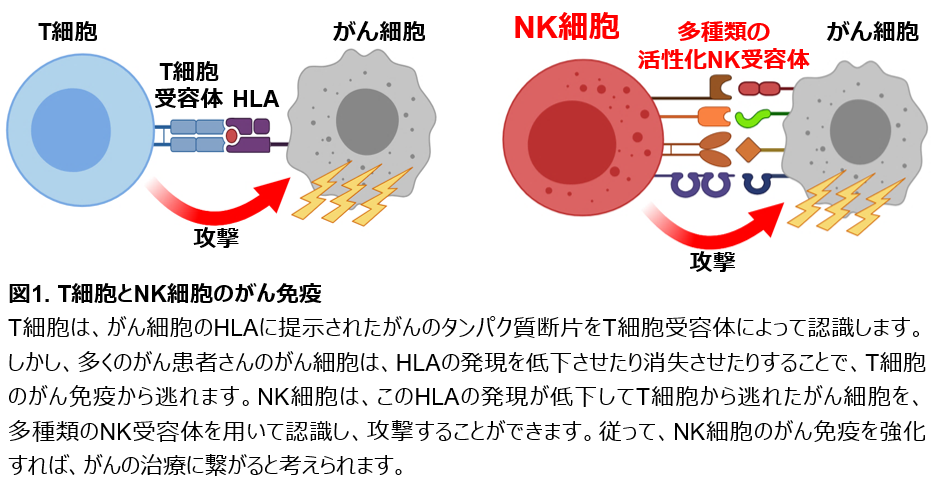
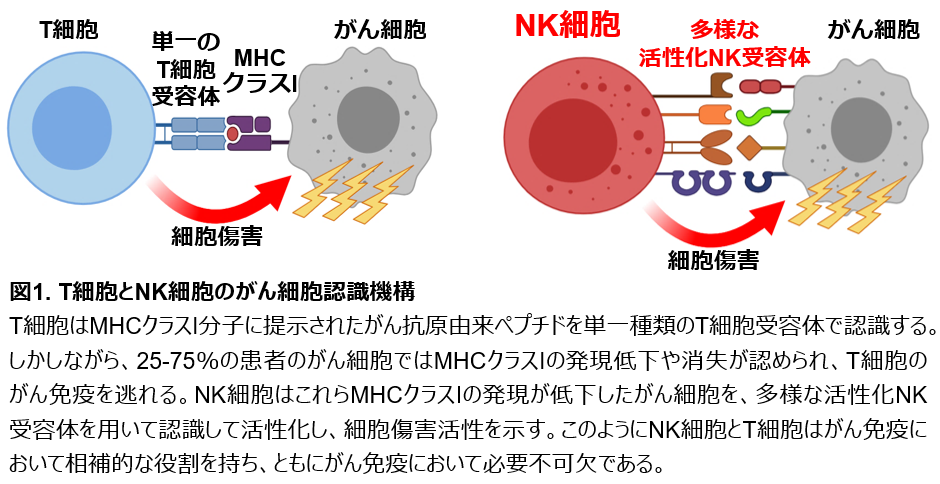
がんを排除する免疫細胞として、NK細胞とT細胞が存在しています。T細胞は、がん細胞の表面にあるヒト白血球抗原(HLA)に提示されたがんのタンパク質断片を、T細胞受容体というタンパク質で認識します。その後、T細胞は活性化し、がん細胞を攻撃します(図1)。しかし、がん細胞はその悪性化に伴ってHLAの発現を低下させたり消失させたりすることで、T細胞に認識され難くなり、最終的にはT細胞のがん免疫から逃れることが知られています。実に、25~75%のがん患者さんで、がん細胞のHLAの発現低下や消失が認められます。一方、NK細胞は、このT細胞が認識できないHLAの発現が低下したがん細胞を、多種類のNK受容体というタンパク質によって認識して活性化し、攻撃することができます(図1)。このように、NK細胞とT細胞は、がん免疫においてお互いを補い合う役割を果たしています。従って、NK細胞のがん免疫を増強すれば、T細胞によるがん免疫療法では完治できないがんを治療できる可能性があるため、NK細胞はがん治療の切り札として注目されています。しかしながら、現在まで、NK細胞のがん免疫を増強する治療薬や、NK細胞を用いた免疫療法は開発されていません。
私たちはNK細胞ががん細胞をNK受容体で認識し、活性化し、攻撃するまでの一連の現象を分子レベルで解明するための基礎研究をしています。さらに、基礎研究から得た知見を活かし、NK細胞がもっと効率良くがん細胞を認識したり、攻撃したりできるような遺伝子改変や薬剤の開発や、機能を強化したNK細胞を利用する免疫療法の開発に向けた橋渡し研究をしています。
(2)当分野での研究内容
NK細胞はT細胞と共にがん免疫の両輪を担うことから、NK細胞のがん免疫を増強する治療法は、従来のT細胞がん免疫を増強する治療法との併用によって、相乗的な治療効果が得られる可能性があります。私たちはNK細胞がん免疫を増強するため、NK細胞の基礎研究から橋渡し研究まで幅広くアプローチしています。
1. NK細胞受容体・リガンド・免疫チェックポイントの同定と、これらを標的にした創薬の研究
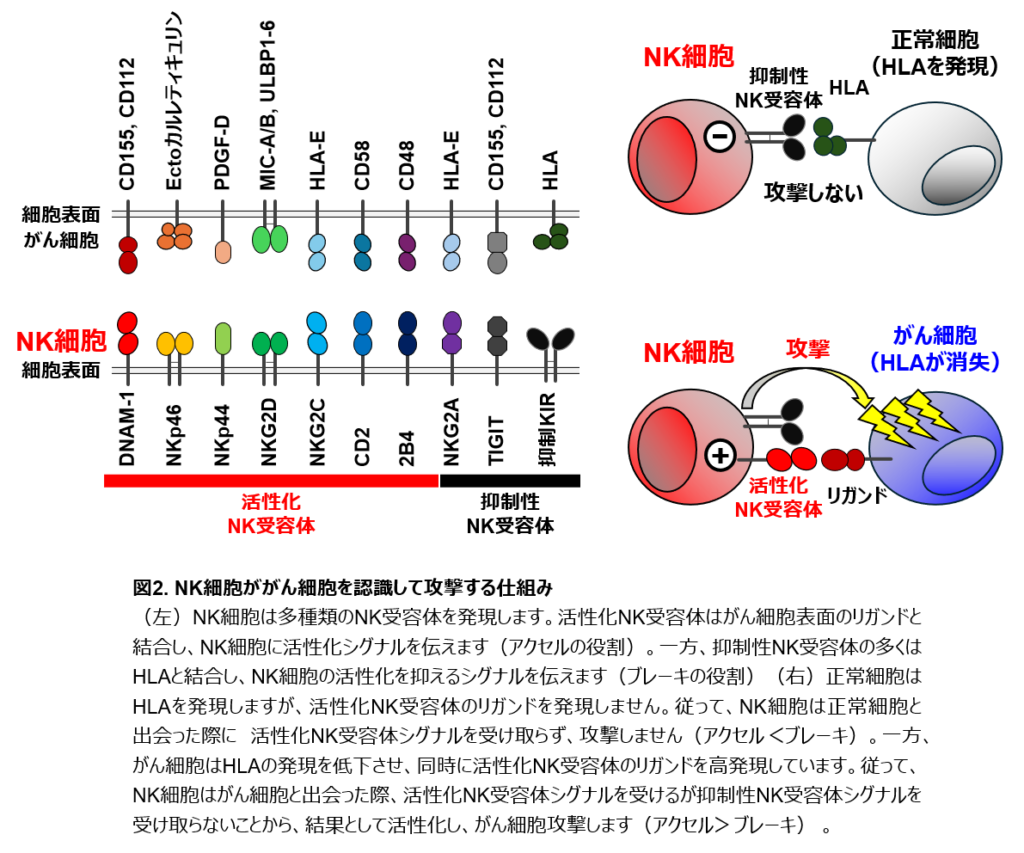
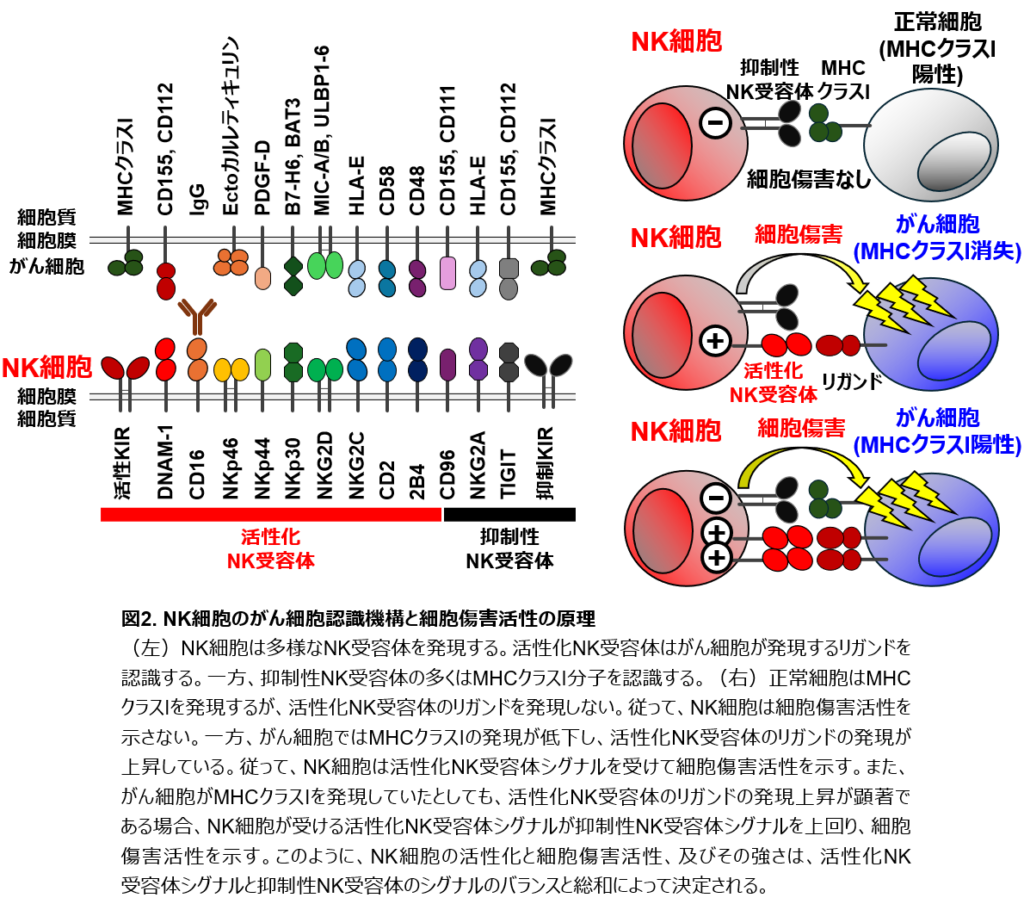
NK細胞は多種類のNK受容体を発現することでがん細胞を認識します。それぞれのNK受容体は、がん細胞の表面に発現する別々のタンパク質(リガンド)と結合します(図2)。NK受容体には、NK細胞を活性化させるシグナルを伝える活性化NK受容体と、NK細胞の活性化を抑えるシグナルを伝える抑制性NK受容体があります。活性化NK受容体はがん細胞表面に多く発現するリガンドと結合し、NK細胞を活性化させます(アクセルの役割)。一方で、抑制性NK受容体の多くはHLAと結合し、NK細胞の活性化や攻撃を抑えます(ブレーキの役割)。正常細胞は活性化NK受容体のリガンドを発現せず、さらに抑制性NK受容体のリガンドであるHLAを発現するので、NK細胞は正常細胞と出会っても活性化NK受容体シグナルを受け取らないので活性化せず、正常細胞を攻撃しません(アクセル < ブレーキ)。一方で、がん細胞は活性化NK受容体のリガンドを高発現し、さらにT細胞から逃れるためにHLAの発現を低下させています。従って、NK細胞はがん細胞と出会った際、活性化NK受容体シグナルを受け取りますが、抑制性NK受容体からのシグナルを受け取りません。結果として、NK細胞は活性化してがん細胞を攻撃します(アクセル > ブレーキ)。このように、NK細胞は活性化NK受容体と抑制性NK受容体から受け取るシグナルのバランス(アクセルとブレーキのバランス)によって、がん細胞だけを攻撃し、さらに活性化NK受容体のシグナルの強さに応じてがん細胞を攻撃します(図2)。しかし、全てのNK受容体のリガンドが同定されているわけではありません。また、がん細胞が多く発現するリガンドを認識するNK受容体が同定されていないこともあります。私たちはこの未知のNK受容体やそのリガンドを同定して機能解析することで、がん免疫における役割を解明し、NK細胞の活性化を人為的に増強ために利用することで臨床応用に結び付けたいと考えています。
また、NK細胞の活性化を抑制する受容体や分子については報告が少ないため、私たちは特にNK細胞のがん免疫を抑制する分子に着目しています。近年注目を浴びている免疫チェックポイント阻害剤は、T細胞のがん免疫を増強する製剤です。免疫チェックポイント阻害剤は、T細胞がん免疫を抑制する免疫チェックポイント分子の機能を妨げることで、がんを認識するT細胞の攻撃力を増強します。一方、NK細胞は、これまでに発見されている免疫チェックポイント分子をほとんど発現していません。従って、NK細胞のがん免疫を増強する1つの方法として、NK細胞の免疫チェックポイント分子を新たに発見し、この機能を妨げる薬剤を開発するという戦略があります。現在、私たちはNK細胞の免疫チェックポイント分子の同定と機能解析を実施しています。遺伝子改変や薬剤などによってNK細胞の免疫チェックポイント分子の機能を妨げることができれば、NK細胞がもっと強力にがん細胞を攻撃できるようになることが期待できます。現在、NK細胞のがん免疫を抑制する分子機構の解明に取り組んでおり、同時にNK細胞のがん免疫を増強する化合物や承認薬の探索をしています。
2. NK細胞の記憶細胞分化の研究
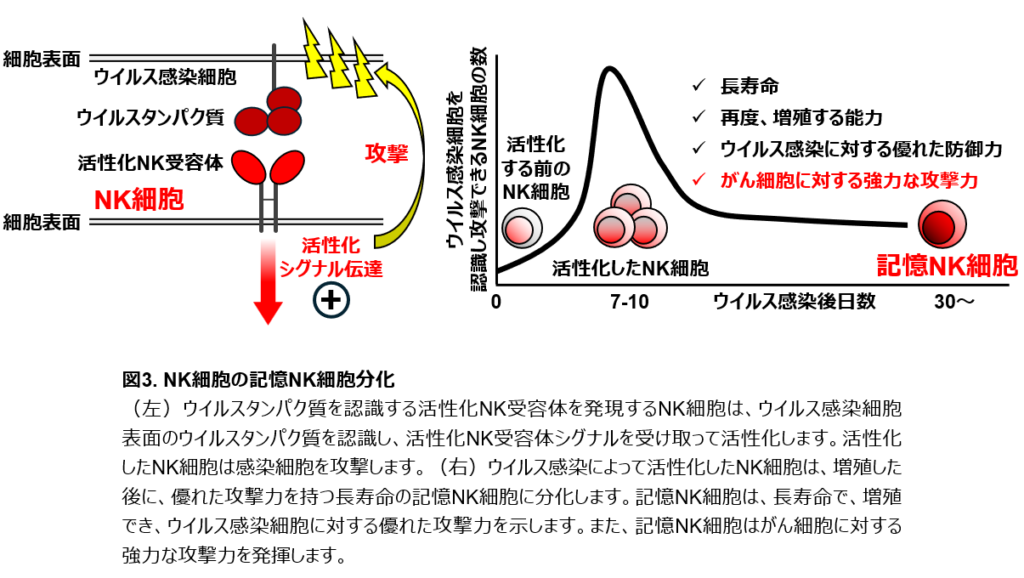
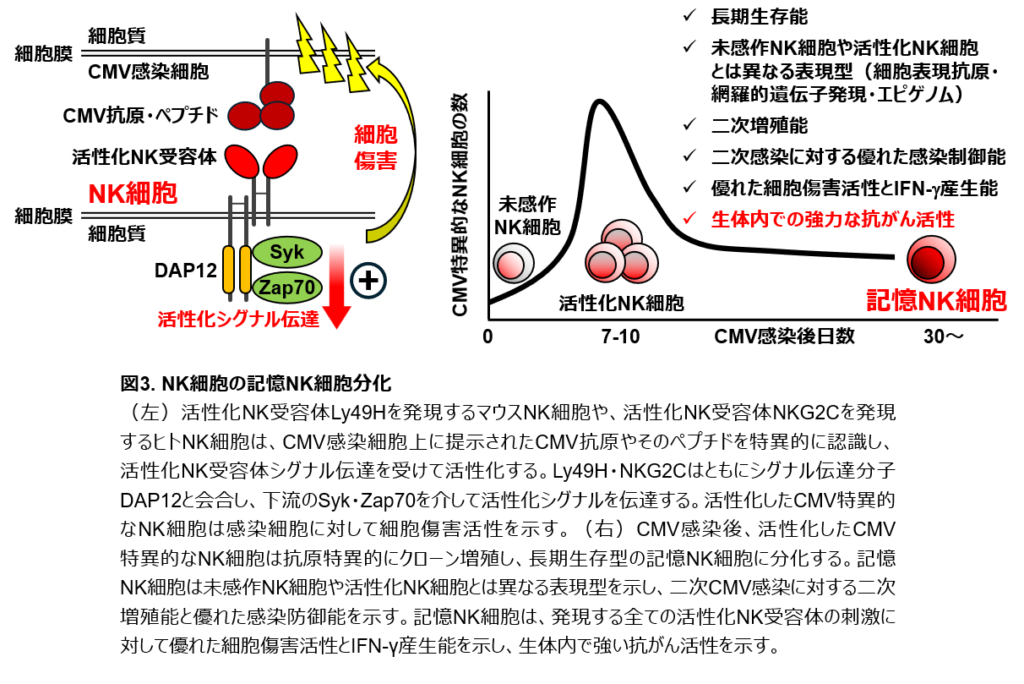
免疫系の最大の特長は免疫記憶です。免疫記憶とは、過去に感染した病原体が再度感染した際、より早くより強い免疫応答が引き起こされ、同じ病原体に対して優れた防御が長い期間維持される現象です。感染症に対するワクチンは、免疫記憶を医療に応用したものです。免疫記憶は、T細胞が記憶T細胞という細胞に分化(性質が不可逆的に変化すること)することによって担われます。記憶T細胞は、数年間から時に生涯に亘って体内で生存する長寿命の細胞で、過去に出会った病原体やがん細胞に再度出会った際、より強く攻撃できるなどの優れた機能を発揮します。近年、持続的で効果的ながん免疫には、がんを認識する記憶T細胞が重要であることがわかってきました。一方、NK細胞の体内での寿命は1~2週間であり、がん細胞を攻撃した後に死滅すると報告されていました。従って、NK細胞はその発見以来、記憶T細胞のような長寿命の細胞に分化することはなく、免疫記憶には関与しないと信じられてきました。しかし近年、ウイルス感染の後、NK細胞が活性化NK受容体からのシグナルによって、増殖した後に、優れた攻撃力を持つ記憶NK細胞に分化して長期間のウイルス感染防御に貢献するという、定説を覆す発見がなされました。記憶NK細胞は通常のNK細胞と異なり、長寿命で、再度増殖でき、ウイルス感染細胞を効率よく攻撃して排除できます(図3)。私たちは記憶NK細胞が、がん細胞に対して強い攻撃力を発揮できること発見しました(図3)。従って、記憶NK細胞は新しいがん免疫細胞療法の開発にとって有用だと考えられます。しかし、NK細胞が記憶NK細胞に分化したり、優れた機能を発揮したり維持できる仕組みは十分に解明されていません。また、ウイルス感染とは異なり、がん患者さんでは記憶NK細胞の分化が観察されないことから、がんではNK細胞が記憶NK細胞に分化するための何らかの条件を満たしていないと考えられます。
私たちは、ウイルス感染後の記憶NK細胞の持つ優れた機能を、がん治療に応用することを目指しています。そのための第一歩として、まずは記憶NK細胞の分化や機能を制御する仕組みを分子レベルで解明するための基礎研究に取り組んでいます。さらに、これら基礎研究の研究から得られた成果をがん免疫に応用するため、人為的にNK細胞を記憶NK細胞に分化させる方法を確立し、記憶NK細胞の強力ながん免疫を利用する次世代のNK細胞がん免疫療法の開発に取り組んでいます。
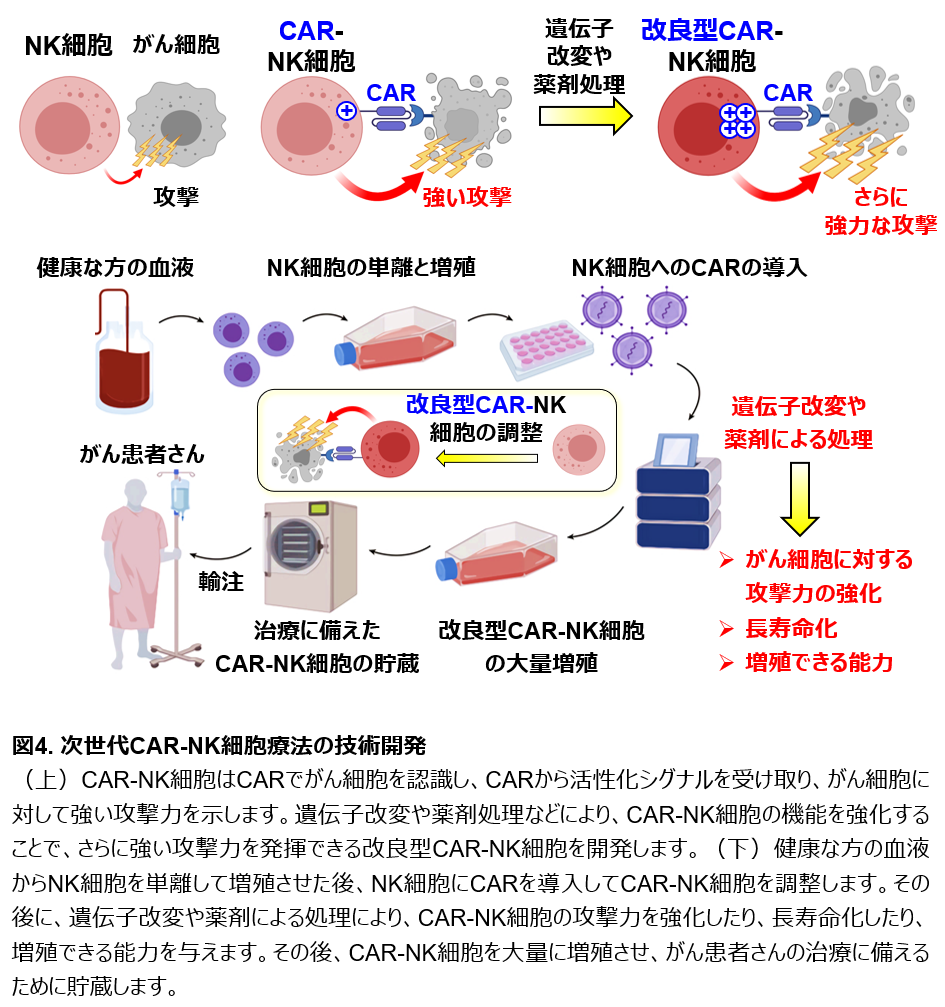
3. 新しいNK細胞免疫療法の開発
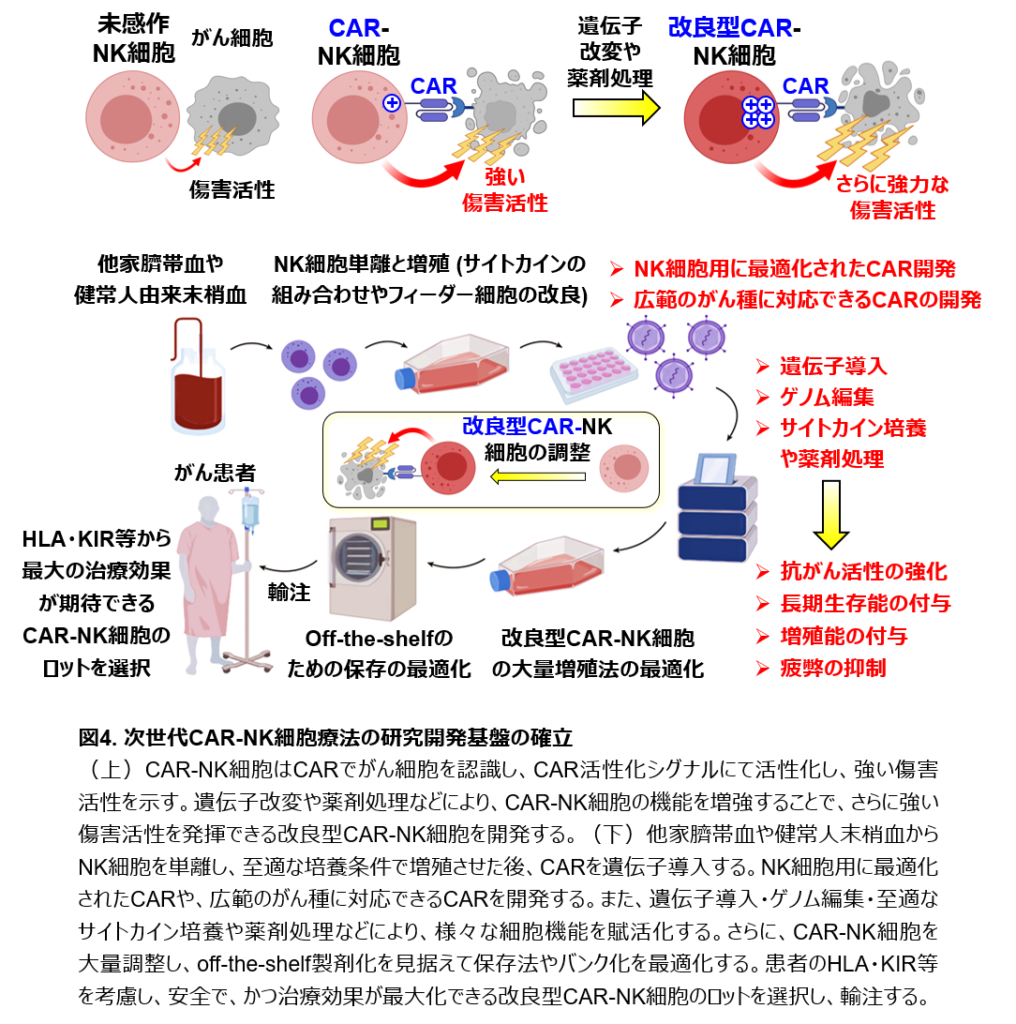
近年、遺伝子改変した免疫細胞を治療薬として用いるがん免疫細胞療法が注目されています。中でも、がん患者さんのT細胞を遺伝子改変し、がんを認識できる人工的な受容体タンパク質(Chimeric Antigen Receptor:頭文字からCARと呼ばれます)を発現させて患者さんに輸注するCAR T 細胞療法は、一部の難治性の造血器腫瘍(白血病やリンパ腫)に対して高い治療効果を示します。CARはがん細胞が多く発現するタンパク質と結合し、T細胞に強い活性化シグナルを伝えることで、T細胞ががん細胞を強く攻撃できるようにします。しかし、CAR T 細胞療法は時に非常に重篤な副作用を生じます。また、CAR T細胞は患者さんの血液のT細胞から個別に調整する必要があるため、進行が速いがんではCAR T細胞の調整に時間がかかって治療が間に合わなかったり、一定の割合で調整自体が失敗したりする危険性があります。これらのCAR T細胞の課題を克服する目的で、CAR-NK細胞療法が注目されています。最新のCAR-NK細胞療法の臨床試験の結果では、造血器腫瘍に対して有効性が確認され、重篤な副作用は発生せず、CAR-NK細胞療法は安全性が高い治療法であることが報告されました。またCAR-NK細胞は健康な方の血液や臍帯血から調整でき、調整後に大量に増殖させて保存することで、たくさんのがん患者さんの治療に備えて貯蔵できるという利点もあります。しかし、現行のCAR-NK細胞は患者さん体内での寿命が短く、がん細胞と出会っても増殖しないなどの理由から、難治性の造血器腫瘍に対する治療効果が十分ではありません。私たちはこれらのCAR-NK細胞療法の欠点を克服し、遺伝子操作や薬剤による処理によって、体内で長期間にわたって生存でき、がん細胞を認識して増殖し、もっと強力にがん細胞を攻撃して排除できるような、安全性と有効性を兼ね備えた改良型CAR-NK細胞を開発したいと考えています(図4)。さらに、現在使用されているCARをNK細胞用に改良したり、様々ながん種の治療に使用できるようなCAR-NK細胞を開発したり、CAR-NK細胞が高い攻撃力を保ったまま効率よく大量に増殖させる材料・方法や、適切な保存方法の開発など、次世代NK細胞療法開発に向けた技術基盤の構築を目指して研究しています(図4)。
目指すもの
NK細胞によるがん免疫を人為的に強化する治療薬や、NK細胞を利用してがんを完治できる免疫療法は、現在まで確立されていません。また、NK細胞が様々なNK受容体によってがん細胞を認識し、活性化シグナルを細胞内で統合し、がん細胞を攻撃する強さを調節する仕組みについては、未だ完全には理解されていません。私たちNK細胞をより深く理解することで、NK細胞によるがん免疫を増強するための創薬や、NK細胞を用いた次世代のがん免疫細胞療法を開発したいと考えています。
研究内容 専門家の方へ
Vision・Big picture・Goal
- 私たちのVisionは、がんを根絶することです。
- 私たちのBig pictureは、NK細胞そのものを理解し、NK細胞のがん免疫の本態を明らかにすることです。
- 私たちのGoalは、NK細胞生物学に根差した、がんを完治できる免疫療法の開発によって、社会に貢献することです。
この目的を達成するため、免疫学や細胞生物学を基幹とし、基礎研究・橋渡し研究・臨床研究の各分野と強固に連携し、様々な知識と技術を取り入れ、生物学・医学・工学などを内包した私たち独自の研究を展開し、がんの治療を目指します。
研究の背景
NK細胞とは
NK細胞は末梢血単核球の2-10%程度しか存在していないリンパ球です。しかしながら、NK細胞はがんの制御に必要不可欠な役割を果たしています。また、NK細胞はサイトメガロウイルス(CMV)に代表されるヘルペスウイルス属のウイルス感染症の制御に必須であり、肝炎ウイルス、エボラウイルス、HIV、SARS-CoV-2など、時に致死的なウイルス感染症の制御にも関与しています。NK細胞はがん細胞などの異常細胞を認識して活性化し、これら標的細胞に対してパーフォリンやグランザイムなどを含む細胞傷害顆粒を放出し細胞傷害活性を示します。同時に、活性化したNK細胞はインターフェロンγ(IFN-γ)を含めたサイトカインやケモカインを産生します。細胞傷害活性やサイトカイン産生はエフェクター機能と呼ばれます。
がん免疫応答
NK細胞とCD8陽性T細胞はがん免疫を担う免疫細胞です。CD8陽性T細胞は、がん細胞表面に発現する主要組織適合複合体(MHC)クラスI分子に提示されたがん抗原由来ペプチドを、単一種類のT細胞受容体にて認識します。その後CD8陽性T細胞は活性化し、がん細胞に対して細胞傷害活性を示します(図1)。しかし、がん細胞はその悪性化に伴ってMHCクラスI分子の発現を低下させ、消失させることでCD8陽性T細胞によるがん免疫応答から逃避します。概して25~75%のがん患者において、がん細胞のMHCクラスIの発現低下や消失が認められます。一方、NK細胞は、CD8陽性T細胞が認識できないMHCクラスIの発現が低下したがん細胞を、多様なNK受容体によって認識して活性化し、細胞傷害活性を示すことができます(図1)。このように、NK細胞とT細胞は、がん免疫において補完し合い、ともに必要不可欠な役割を果たしています。
がん免疫療法の課題
免疫チェックポイント阻害剤に代表される免疫療法は、がん治療の選択肢としての地位を確立しました。しかしながら、がん免疫療法の治療効果は未だ限定的であり、完治に至るがん種は限られています。また、現行のがん免疫療法は、時に重篤な副作用が発生します。従って、既存の治療法に対するがんの抵抗性獲得や、従来の治療法との併用による相乗的な治療効果を見据え、安全性と治療効果がともに高く、かつ作用機序が異なる新しい免疫療法の開発が常に求められています。がんに対する免疫療法の開発研究は、T細胞を中心に進められています。T細胞がん免疫による免疫療法に対する主たる治療抵抗性の分子機序として、がん細胞のMHCクラスI分子の発現低下が挙げられます。NK細胞は、これらMHCクラスIの発現が低下してT細胞が認識できないがん細胞を、認識して排除することができます。NK細胞はT細胞と共にがん免疫の両輪を担うことから、NK細胞のがん免疫応答を賦活化できれば、CD8陽性T細胞の活性化によるがん免疫療法では完治できないがんを治療できる可能性があります。NK細胞が近い将来、がん治療のゲームチェンジャーになることが期待される一方で、現在までNK細胞の抗がん活性を増強する治療法や創薬は未だ開発されていません。
研究概要
腫瘍免疫応答研究分野では、NK細胞によるがん免疫応答を研究しています。NK細胞は、T細胞が排除できないがん細胞を認識して活性化し、排除できるため、次世代の免疫療法の開発にとって有用だと考えられています。しかしながら、当該研究分野の多くの研究者の努力にも関わらず、NK細胞のがん免疫応答を増強する創薬や、難治がんの完治に至るNK細胞がん免疫療法は開発されていません。NK細胞がん免疫を賦活化する方策を確立するためには、NK細胞がNK受容体を用いてがん細胞を認識し、活性化シグナル伝達にて活性化し、細胞機能が調節されて細胞傷害活性を発揮するまでの一連の分子制御機構を解明し、より深く理解する必要があります。また、NK細胞の抗がん活性を増強するためには、治療標的となる新規抑制分子や免疫チェックポイント分子の同定と機能解析が必須です。私たちは、これら基礎研究から得た成果を橋渡し研究に昇華し、NK細胞がん免疫を増強する創薬の開発や、次世代NK細胞がん免疫療法の研究基盤とproof-of-conceptを構築することを目的としています。また、新しく開発したNK細胞免疫療法は、臨床試験にて安全性と有効性を確認した上で、最終的にはがんの治療選択として提供すること目指しています。
研究内容
現在、NK細胞によるがん免疫の賦活化法は確立されていません。NK細胞はT細胞と共にがん免疫の両輪を担うことから、NK細胞のがん免疫を増強する治療法や創薬は、T細胞のがん免疫応答を活性化する免疫チェックポイント阻害剤や分子標的薬従来との併用により、相乗的な治療効果が得られる革新的な創薬となり得ます。私たちはNK細胞のがん免疫応答を賦活化するため、NK細胞がん免疫の免疫細胞生物学的な基礎研究から橋渡し研究や創薬研究に至るまで、免疫学と細胞生物学を基幹としながら分野横断的にアプローチしています。
1. NK細胞受容体・リガンド・免疫チェックポイントの同定と機能解析、及びこれらを標的にした創薬の開発研究
NK細胞はその細胞表面に多様な活性化NK受容体、及び抑制性NK受容体を発現します(図2)。活性化NK受容体はがん細胞などの異常細胞の表面で発現上昇する分子をリガンドとして認識します。活性化NK受容体-活性化リガンド相互作用は活性化シグナルを伝達し、NK細胞の活性化とエフェクター機能を誘導します。一方、抑制性NK受容体の多くはMHCクラスI分子をリガンドとして認識し、NK細胞に抑制性シグナルを伝達します(図2)。正常細胞はMHCクラスIを発現する一方、がん細胞の多くはT細胞免疫から逃れるためにMHCクラスIの発現を低下させます。即ち、NK細胞は正常細胞との抑制性NK受容体-MHCクラスI相互作用によって抑制性シグナルを受け取るため活性化せず、正常細胞に対して細胞傷害活性を示しません(活性化NK受容体シグナル < 抑制性NK受容体シグナル )(図2)。一方、がん細胞はMHCクラスIの発現を低下させているため、NK細胞はがん細胞との相互作用で抑制性NK受容体シグナルを受理しません。さらに、がん細胞は活性化NK受容体リガンドを高発現しているため、NK細胞は活性化NK受容体シグナルを受けて活性化し、がん細胞に対して細胞傷害活性を示します(活性化NK受容体シグナル > 抑制性NK受容体シグナル )(図2)。また、がん細胞・DNA損傷を受けた細胞・形質転換した細胞などのように、MHCクラスIの発現が保たれていたとしても、活性化NK受容体リガンドの発現上昇が顕著であればNK細胞は活性化NK受容体シグナルを受けて活性化し、細胞傷害活性を示します(活性化NK受容体シグナル > 抑制性NK受容体シグナル )(図2)。即ち、NK細胞の活性化やエフェクター機能、およびその強度は、活性化NK受容体・抑制性NK受容体のシグナルのバランスと総和によって規定され、活性化NK受容体シグナルの総和が抑制性NK受容体シグナルの総和を上回ればNK細胞は活性化しエフェクター機能を示します(図2)。結果として、NK細胞はがん細胞に対して選択的に細胞傷害活性を発揮してこれを排除することができます(図2)。従って、NK受容体、リガンド、受容体下流シグナル伝達分子の同定と機能解析は、NK細胞生物学における最重要のトピックです。
しかし、全てのNK受容体-リガンド相互作用が決定されている訳でなく、がん免疫応答に関与することが知られているNK受容体のリガンドが同定されていないこともあります。また、がん細胞が高発現する分子をリガンドとして認識する活性化NK受容体や抑制性NK受容体の同定は、NK細胞がん免疫を人為的に調節することに直結し得るため、重要な意義を持ちます。また、NK細胞はがん細胞を認識した際、複数の活性化NK受容体、及び抑制性NK受容体から同時にシグナルを受け取ります。しかしながら、これら活性化・抑制性NK受容体シグナルが細胞内でどのように統合され、調節されているのかについては完全に理解されていません。私たちはこれら未知のNK受容体やそのリガンド、並びにNK受容体シグナル統合機構に関与する分子を同定して機能解析することで、がん免疫における役割を決定し、NK細胞の活性化を人為的に増強するような方策を開発し、臨床応用に結び付けたいと考えています。
また、NK細胞のがん免疫を抑制する分子については報告が限られています。NK細胞のがん免疫を増強する1つの方策として、NK細胞が発現する免疫チェックポイント分子の阻害剤の開発や、遺伝子改変などによる当該免疫チェックポイント分子の遺伝子破壊が考えられます。しかし、NK細胞は既知の免疫チェックポイント分子を高発現しないことから、NK細胞がん免疫を増強するためには、治療標的となる新しい抑制分子や免疫チェックポイント分子の同定と機能解析が必要です。NK細胞の抗がん活性を賦活化する創薬標的として、多様な活性化NK受容体シグナル伝達経路を抑制するシグナル伝達分子が有力だと考えられますが、現在まで当該抑制分子は同定されていません。近年、私たちはNK細胞がん免疫を抑制する分子に着目し、NK細胞の免疫チェックポイント分子の同定と機能解析を実施しています。現在、私たちが新たに同定したNK細胞がん免疫の免疫チェックポイント分子について、詳細な機能解析と抑制分子機構の解明に取り組んでいます。同時に、NK細胞免疫チェックポイント分子阻害剤の開発のため、構造生物学的なアプローチや人工知能を用いた化合物ライブラリー探索により、NK細胞のがん免疫応答を増強する低分子化合物の探索や、リポジショニング可能な承認薬の探索を実施しています。
2. 記憶NK細胞の分化の機能の分子制御機構の解明
免疫系の最も特筆すべき機能の1つは免疫記憶です。免疫記憶とは、ワクチンに代表されるように、一度曝露された異物への再曝露の際、より早くより強い免疫応答が惹起され、優れた生体防御能が長期間維持される現象です。また、持続的で効果的ながん免疫応答にもCD8陽性T細胞の免疫記憶が必要です。免疫記憶は、記憶細胞に分化できるT細胞とB細胞によってのみ担われると考えられていました。一方、NK細胞はその発見以来、1~2週間で死滅する短寿命細胞であり、エフェクター機能を示した後に死滅すると考えられてきました。従って、NK細胞はCD8陽性T細胞のような抗原特異的増殖能や長期生存型の記憶細胞への分化能は持っておらず、免疫記憶には関与しないと信じられていました。しかし近年、CMVの感染後、活性化NK受容体Ly49Hを発現するマウスNK細胞や、活性化NK受容体NKG2Cを発現するヒトNK細胞がCMV感染細胞を認識し、抗原特異的な増殖を経て、記憶NK細胞に分化して長期間の感染防御に寄与するという定説を覆す発見がなされました(図3)。これら活性化NK受容体は、感染細胞上に発現するCMVタンパク質やその断片を特異的に認識し、シグナル伝達分子DAP12と会合し、Syk・Zap70を介して活性化シグナルを伝達します。活性化したNK細胞は細胞傷害活性を示して感染細胞を排除し、感染初期の感染防御を担います。その後、これら活性化NK細胞はクローン増殖し、長期生存型のNK細胞として生体内に残存します。この長期生存型NK細胞は、①クローン増殖を経た長期生存型NK細胞で、②未感作NK細胞・活性化NK細胞とは異なる独自の細胞表面抗原の発現・網羅的遺伝子発現・エピジェネティックプロファイルを示し、③in vitroにおいて未感作陽性NK細胞よりも優れたエフェクター機能を示し、④二次CMV感染に対して二次増殖能を持ち、⑤未感作NK細胞よりも優れたCMV感染防御能を持つ、という特性を示し、免疫記憶の定義を満たすことから記憶NK細胞と定義されました(図3)。興味深いことに、記憶NK細胞は発現する全ての活性化NK受容体の刺激に対し、未感作NK細胞よりも強いエフェクター機能を示します。これは、記憶細胞分化に伴って遺伝子発現やエピゲノムが網羅的に変化し、結果として活性化NK受容体シグナル伝達の閾値が低下することで、記憶NK細胞は活性化NK受容体の種類を問わず、全方位的に強いエフェクター機能を発揮できるようになるためだと考えられています。実際に、記憶NK細胞は、がんの排除に重要な活性化NK受容体DNAM-1やNKG2Dのシグナル伝達に対しても優れた細胞傷害活性を示すため、強力な抗がん活性を示します。また、記憶 NK細胞は、活性化NK受容体CD16を介した強い抗体依存性細胞傷害(ADCC)活性を示します。記憶NK細胞は骨髄移植や臓器移植に伴うCMV再感染後に二次増殖し、感染制御に貢献します。さらに記憶NK細胞はHIVやSARS-CoV-2感染の重症化を防いでいる可能性があります。NK細胞免疫記憶の重要な臨床的意義として、記憶NK細胞が造血器腫瘍患者の微小残存病変を排除することで、再発率の低下と患者の生存率の向上に寄与していることが報告されています。また、記憶NK細胞の強いADCC活性は、ADCCを主たる作用機序とする抗体医薬品(Trastuzumab、Cetuximab、Rituximab、Avelumabなど)の治療効果に寄与している可能性があります。
私たちは、がん免疫への応用を見据えてNK細胞免疫記憶の研究に従事する中で、記憶NK細胞が強力な抗がん活性を持つことを発見しました。記憶NK細胞は強力な抗がん活性だけでなく、長期生存能・優れた細胞傷害活性・増殖能を備えています。これら記憶NK細胞の特性はがん免疫療法の開発において有用であると考えられることから、その分化や機能の分子制御機構の解明は基礎的・臨床的に重要な意義を持ちます。これまでに、私たちを含めた研究グループが、NK細胞受容体・サイトカイン・シグナル伝達分子・転写因子など様々なNK細胞関連分子の役割を決定してきました。しかしNK細胞の免疫記憶の本態が理解されたとは言い難く、T細胞の免疫記憶の理解度には及びません。また、現在まで、がん患者では記憶NK細胞分化が観察されていないことから、がんではNK細胞免疫記憶の形成の必要条件となる環境因子やシグナル伝達が欠如していると考えられます。今後、記憶NK細胞分化が観察される疾患の探索、記憶NK細胞分化を誘導するNK受容体-リガンド相互作用やサイトカインなどのシグナル伝達経路の研究、記憶NK細胞のアイデンティティを決定する転写因子やエピジェネティック因子の同定と機能解析により、NK細胞免疫記憶の理解を深めることが必要です。私たちはNK細胞免疫記憶を分子レベルで解明するための基礎研究をしています。同時に、NK細胞免疫記憶の分子制御機構の解明を通し、遺伝子導入・ゲノム編集・化合物などを用いた人為的な記憶NK細胞分化により、NK細胞がん免疫を増強したり、腫瘍に浸潤し疲弊状態に陥ったNK細胞を再活性化したりするなど、記憶NK細胞の特性をがん免疫に応用すること目指しています。
3. 次世代NK細胞免疫療法の研究基盤の構築
がんに対する免疫療法の奏効率は未だ十分でなく、完治に至るがん種は限られています。近年開発された新しい治療法の1つに、がん特異的キメラ受容体(Chimeric Antigen Receptor)T細胞療法があります。がん特異性を付与する人工活性化受容体であるCARを遺伝子導入されたT細胞は、がん細胞を特異的に認識でき、CAR活性化シグナル伝達により活性化して細胞傷害活性を示します。がん患者の末梢血T細胞を単離し、CARを導入したT細胞を細胞製剤として患者に輸注するCAR T 細胞療法は、難治性B細胞性腫瘍に対し高い治療効果を示します。しかし、サイトカイン放出症候群や神経毒性などの重篤な副作用が発生します。また、CAR T細胞は、患者本人の末梢血T細胞から個別に調整する必要があるため、進行が速いがんでは時に治療機会を逸失したり、一定の割合で調整が失敗したりする危険性があります。これらのCAR T細胞の課題を克服する目的で、NK細胞が注目されています。近年、NK細胞がん免疫の賦活化法としてCAR-NK細胞療法が開発されました。昨今、他家臍帯血NK細胞から調整されたCAR-NK細胞を用いた臨床試験において、CAR-NK細胞療法のB細胞性腫瘍に対する有効性が報告されました。同臨床試験ではグレード2以上の移植片対宿主病・サイトカイン放出症候群・神経毒性などの重篤な副作用は確認されず、CAR-NK細胞療法はCAR T細胞療法と比較して安全性に優れることが示されました。また、他家臍帯血や健常人末梢血のNK細胞から調整するCAR-NK細胞は、大量調整と保存が可能であることから、将来的にはoff-the-shelf製剤としての利用可能性が高いと考えられます。さらに、CAR-NK細胞は、CARだけでなく、内在性の活性化NK受容体もがん細胞を認識できるため、これら活性化NK受容体シグナルも細胞傷害活性の増強に寄与し、がん細胞の排除に貢献します。しかしながら、現行のCAR-NK細胞は患者体内での生存能が乏しく、がん細胞を認識した後も増殖能が乏しく、また、難治性B細胞性腫瘍に対する治療効果が低いという課題があります。また、NK細胞とT細胞の抗原受容体・共刺激分子・シグナル伝達分子・重要なサイトカインなどが必ずしも同一でないにも関わらず、CAR-NK細胞を調整するために用いられるCARのほとんどが、CAR T細胞療法で利用されている第2世代CARを用いていること(CAR T細胞療法の最新のCARは第5世代)など、CARの構造がNK細胞用に最適化されていないという点を指摘する声もあります。
私たちは、これら現行のCAR-NK細胞療法の課題を克服すべく、遺伝子導入・ゲノム編集・サイトカイン培養の至適化・薬剤処理などによってCAR-NK細胞に長期生存能や増殖能を付与しつつ、同時にさらに抗がん活性を増強した改良型CAR-NK細胞の調整法を確立することを目指しています(図4)。また、腫瘍細胞に浸潤したNK細胞が機能不全(疲弊)に陥ることが知られていますが、遺伝子改変により疲弊しにくいCAR-NK細胞を調整することにも挑戦しています。同時に、CAR-NK細胞の細胞機能増強や治療効果亢進における分子機構を解明することで、新しいNK細胞の抑制因子や治療標的分子が同定できる可能性があり、さらに治療効果が高い改良型NK細胞療法の研究開発に展開できます。加えて、CAR導入のためのより良いNK細胞の増殖法や材料(フィーダー細胞やサイトカインの組み合わせ)の樹立、NK細胞に対する高効率の遺伝子導入法やゲノム編集法、NK細胞に特化したCAR構造の最適化、広範のがん種に対応できるCARの開発、高い抗がん活性を保持したままCAR-NK細胞を大量増殖できる培養条件の確立、最適な保存方法やバンク化の検討、がん患者やドナーNK細胞のMLA・KIR・CMV感染プロファイルなどから安全かつ治療効果を最大化できるCAR-NK細胞のロットを選択するプログラムの開発など、様々な基盤技術の確立を目指します(図4)。これらの研究開発を通じ、次世代NK細胞療法のための研究開発基盤を構築します。
スタッフ紹介
【キーワード・専門技能】
NK細胞・NK受容体・免疫記憶・1型自然リンパ球
免疫学・細胞生物学・血液学・分子生物学
がん免疫・がん免疫療法・ウイルス感染
フローサイトメトリー・初代細胞培養・骨髄移植
researchmap
Google Scholar
2021年日本学術振興会特別研究員PD,2022年–2025年千葉大学国際高等研究基幹特任助教。2025年4月より現職。
【キーワード・専門技能】
酵素,リン脂質,生理活性脂質,タンパク質間相互作用,脂質代謝酵素,液体クロマトグラフィー-タンデム質量分析法(LC-MS/MS),ホスホリパーゼC,ホスファチジン酸ホスファターゼ,がん免疫
researchmap
Google Scholar
業績
人材募集
腫瘍免疫応答研究分野では、NK細胞によるがん免疫の分子制御機構を解明しようとする基礎研究と、NK細胞がん免疫の賦活化法の臨床応用を目指すトランスレーショナル研究をしています。免疫学・細胞生物学・分子生物学・生化学・細胞工学・バイオインフォマティクス・がん治療学・がん生物学・医学など、多様な研究背景の熱意ある研究者を歓迎します。研究員(任期無し・任期付き)、創発RA、リサーチレジデント、連携大学院生、非常勤、アルバイトなど様々な受け入れ体制がありますので、私たちの研究に興味がある方はぜひ御連絡ください。

