重点プロジェクト研究
がん研究と医療が日本で一番進んだ「がんにならない、なっても安心な愛知県」を目指して、重点プロジェクトを進めています
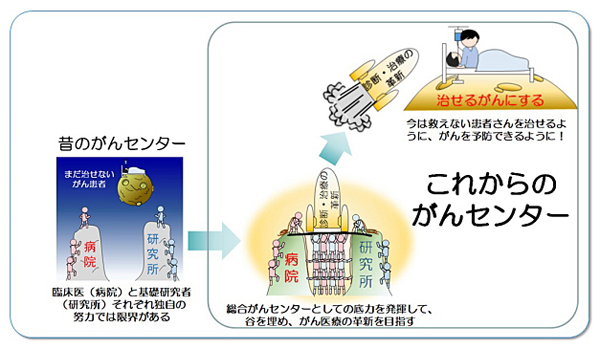
当センターは、臨床への導入が始まりつつあるゲノム医療への対応のために、病院に2017年4月に個別化医療センターを、2018年4月にリスク評価センターを開設し、さらに2019年3月にはがんゲノム医療センターを整備しました。また、研究所にキャンサーバイオバンク愛知を設置し、ゲノム解析の情報と生活習慣などの疫学的情報の付帯する血液及び組織試料の系統的収集を開始しました。さらに、2018年4月には研究所の全面的な組織再編を行い、基礎と臨床の橋渡しを担うトランスレーショナルリサーチと予防に関わる研究分野を中心に、体制の大幅な強化を進めてきました。
それを受けて、がん研究と医療が日本で一番進んだ「がんにならない、なっても安心な愛知県」の実現に、研究所と病院を併設する総合がんセンターとしての強みを最大化して貢献するべく、2019年度に総合がんセンター機能強化推進事業を立ち上げました。当センターの研究所と病院は、伝統と実績に安住せず両者一丸となって、次世代のがんの予防と医療を創出すべく、以下の4つの重点プロジェクトを強力に推進しています。
1)がんゲノム予防医療プロジェクト
1-1)大規模病院疫学研究を基盤とした遺伝性腫瘍のリスク群における個別化予防を志向したエビデンス創出研究
- 研究所:分子遺伝学分野、がん予防研究分野、がん情報・対策分野、システム解析学分野
- 病院:内視鏡部、消化器内科部、消化器外科部、手術部、集中治療部、乳腺科部、婦人科部、頭頸部外科部
がんゲノム医療が進展するに従い対応がますます重要となる遺伝性腫瘍の日本人における頻度やリスク評価手法の研究を進めて、リスク群の推定と適切な介入法の開発による個別化予防を目指す課題。
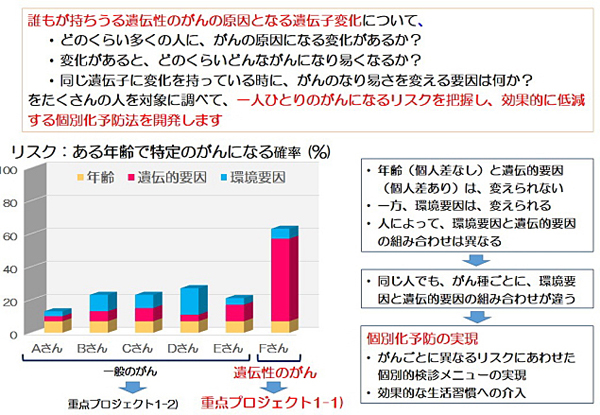
がんを発症された方の3-5%は、生まれつき特定の遺伝子の変化があることで特にがんになり易い体質を持つ「遺伝性腫瘍」とされ、約100種類が知られています。遺伝性腫瘍は決して稀な病気ではなく、「自分はがんになっていないので関係ない」とはいえません。米国の女優の告白により世界で知られるようになった遺伝性乳がん卵巣がん症候群や、大腸がん・子宮内膜がんなど様々な腫瘍ができるリンチ症候群は、特に頻度が高い遺伝性腫瘍です。生まれつきの遺伝子の変化があることでがんを発症された方は、がんが治った後も同じあるいは他の臓器に新たにがんを発症するリスクがあります。さらに、発症者と同じ遺伝子の変化を持つ血縁者は、まだがんになっていなくても決まった確率でがん発症のリスクがあります。若年でがんを発症しやすいこうした方々のがんを予防あるいは早期発見して早期治療につなげることは、働き盛り・子育て世代の方々の人生を左右する重要なことです。
本研究では、県民の皆様のがんを早く見つけて治癒させる個別化予防を目指して、日本人における正確な遺伝子変化の頻度を明らかにし、遺伝性腫瘍の体質やがん発症リスクを予測する方法を開発します。
1-2)大規模病院疫学研究をベースとした環境要因・遺伝要因を用いた散発性がんの個別化予防を志向したエビデンスの創出研究
- 研究所:がん予防研究分野、がん標的治療TR分野、がん情報・対策研究分野、システム解析学分野
- 病院:リスク評価センター、内視鏡部、消化器内科部、消化器外科部、手術部、集中治療部、頭頸部外科部、乳腺科部、呼吸器内科部、呼吸器外科部
ゲノム上の個人差(遺伝性の腫瘍を起こすような異常ではない)と、生活習慣や環境要因との相互作用をもとに、一般的な散発性のがんへの罹りやすさを推定して個別化予防を目指す課題。
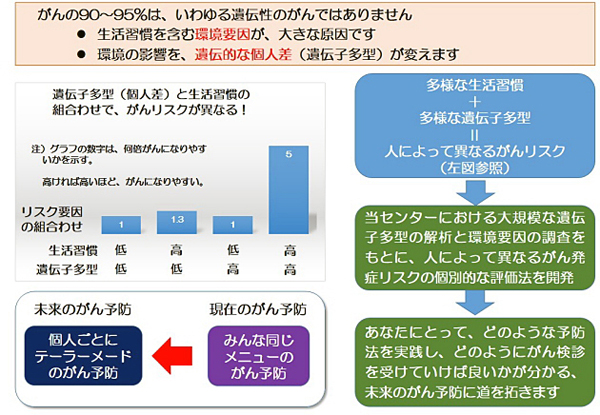
現在、日本では二人に一人が生きている間にがんにかかる、という時代になっています。この背景には、高齢化や生活習慣の変化の影響があるわけですが、見過ごされている重要なものとして、遺伝的な情報があります。がんのなりやすさに影響を受けているのは、いわゆる遺伝性のがんだけではありません。誰もがなり得る普通のがんにも、実は遺伝子に基づく「なりやすさの個人差」が存在する事が、愛知県がんセンターで20年以上の長きにわたり実施してきた大規模な疫学研究によって明らかになってきています。
がんを予防する上で、二つ大きなアプローチがあります。一つは、がんになりにくくする一次予防です。もう一つに、がんを早く見つける二次予防、一般にがん検診と呼ばれているものがあります。現在これらの予防は、万人を対象に全て同一メニューで提供されています。しかしながら、遺伝子に基づく「なりやすさの個人差」を予防に組み入れることで、実は予防への取り組み方のオーダーメイド化が可能です。本研究では、これまでの万人向けの予防を超えた、あなたのための予防、というものを創出しようとしています。
2)がん超精密医療プロジェクト
2-1)分子標的治療薬に対する耐性機序解明に関わる基盤形成
- 研究所:がん標的治療TR分野、分子診断TR分野
- 病院:薬物療法部、呼吸器内科部、外来部
がんのアキレス腱を狙い撃つ分子標的薬による治療の最適化や、必発ともいえる治療に対する耐性獲得の分子機序の解明を進め、その効果的な対処法の開発を目指す課題。
がんは多くの遺伝子異常が蓄積して発生します。しかし、それらの異常の中でも、とくにがんの生存・増殖にとって大事な働きを担っている異常(分子標的)をピンポイントに狙い撃ちするのが分子標的薬と呼ばれる治療薬です。分子標的薬は約20年前に登場し、これまで多くの患者さんの治療に貢献してきました。しかしながら、いまだにがんのアキレス腱のような大事な異常と言われながら、治療薬の開発が遅れている分子標的が存在することや、治療開始当初はよく効いた分子標的薬も1-2年すると効かなくなること(耐性化)が問題となっています。
本研究では、分子標的薬が効かない・効かなくなる理由を、センター内に蓄積された豊富ながん組織試料を用いて、分子生物学的手法を駆使することで明らかにします。そして、現在有効な治療薬のない標的に対して新たな薬を開発することや、耐性化を解除することにより進行期のがんにかかっても十分な治療効果を長期間にわたり得られるような治療法の開発を目指します。
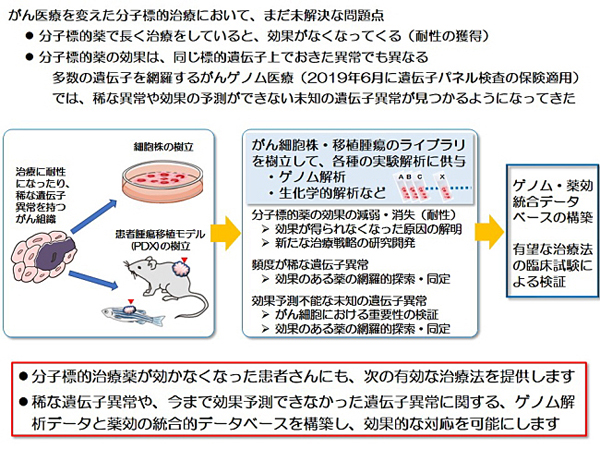
2-2)難治がんPDXモデルのライブラリー整備とその多層的オミクス解析による統合データ基盤構築
- 研究所:分子診断TR分野、腫瘍免疫制御TR分野、がん標的治療TR分野
- 病院:消化器内科部、消化器外科部、呼吸器内科部、呼吸器外科部、外来部
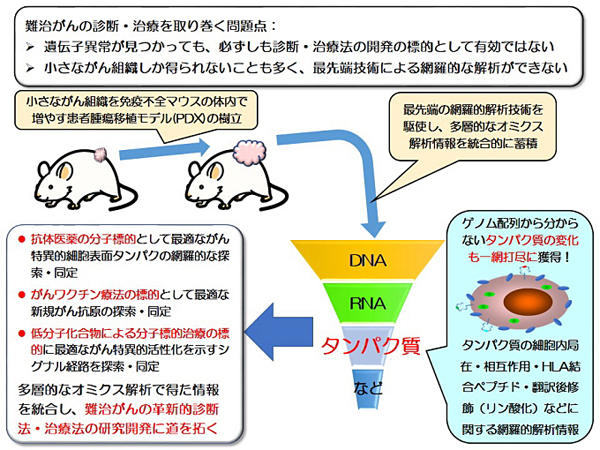
膵臓癌などの難治がんの患者腫瘍移植モデルのライブラリーを整備し、革新的な診断法や治療法の開発に資する、ゲノムと蛋白の多層的オミクス解析を通じた統合的情報基盤の構築を目指す課題。
難治がんとは、症状が出にくく早期に診断することが難しい、また有効な治療法が少なく治りにくいがんのことを指し、脳腫瘍、肺がん、膵がん、胆のうがんなどが当てはまります。近年のゲノム解析技術の進歩により、難治がんにおいても、どのような遺伝子に異常があるのか、ということについては明らかになりつつあります。しかし、いまだに有効な診断・治療法の開発には至っておらず、難治がんを克服するためには、新しい解析技術の導入による革新的な取り組みが必要です。
本研究では、患者さんから生検などによっていただいた少量のがん細胞を、直接マウスに移植することで、十分大きな腫瘍にします。これを患者腫瘍組織移植モデル(PDXモデル)といいます。PDXモデルにより、今までわずかな検体では調べることのできなかった何千という規模のタンパク質の網羅的解析なども可能になります。このような取り組みは、世界でも類を見ないものであり、研究所と病院が隣接している愛知県がんセンターの強みを最大限に生かしたものです。本研究によって、ゲノム解析だけではわからないような知見が得られ、難治がんの新しい診断・治療法の開発につながることが期待できます。
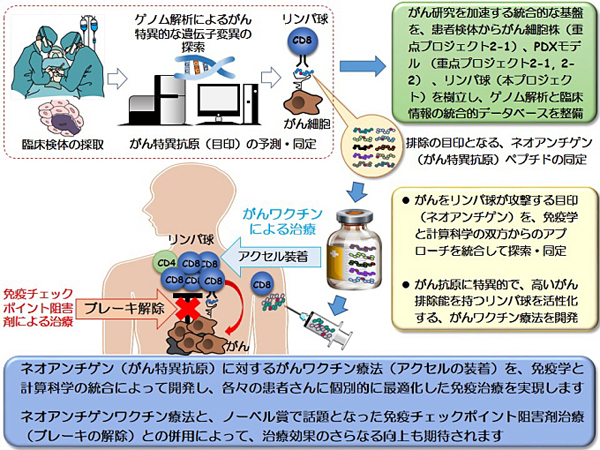
3)がん免疫ゲノムプロジェクト
3-1)ネオアンチゲンを標的としたがんワクチン療法の開発
- 研究所:腫瘍免疫制御TR分野、システム解析学分野、がん標的治療TR分野、分子診断TR分野、腫瘍免疫応答研究分野
- 病院:呼吸器外科部、呼吸器内科部、外来部
第4の治療法として期待されるがん免疫治療の革新を、がん特異的なゲノム異常に起因する異常蛋白を目印に、患者自身の免疫細胞のがん排除機能を増強して実現することを目指す課題。
がんの免疫療法(免疫チェックポイント阻害剤)は、2018年度のノーベル生理学・医学賞受賞で脚光を浴びました。しかしながら、その治療効果がまだ限定的であることも事実です。したがって、治療効果をさらに上げるためには、免疫系とがんとの関係をより明らかにする必要があります。とくに免疫系の細胞が、がんを認識して排除する際の目印(がん抗原)について、一人ひとりの患者さんで明らかにすることが重要となります。
本研究においては、最新のゲノム解析技術を活用しつつ、それぞれの患者さんのがんに特異的なゲノム異常に起因するがん抗原(ネオアンチゲン)を、計算科学と免疫学的な実験を組み合わせて探索・同定します。そして、ネオアンチゲンを目印にした自己の免疫細胞によるがん細胞の排除を増強するための、革新的ながんワクチン療法の開発へとつなげていきます。開発するがんワクチン療法(アクセル)を、がんの微小環境における免疫抑制を解除する免疫チェックポイント阻害剤(ブレーキの解除)による治療と併用すれば、治療効果を大きく向上させられると期待できます。本研究の遂行には、がん治療経験が豊富な病院のがん専門医と、がん免疫学研究やコンピューターサイエンスをリードする研究所の研究者が、密接に共同して当たります。
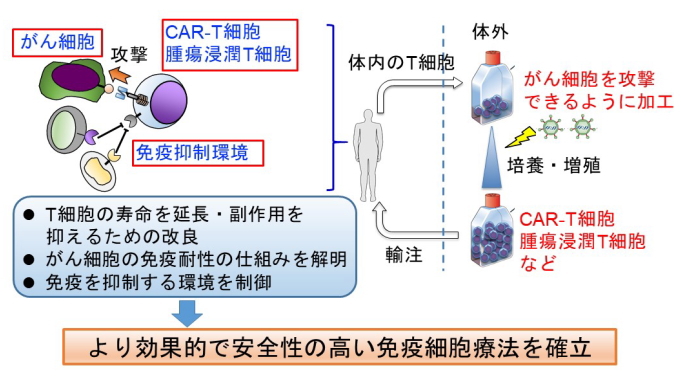
3-2)遺伝子改変による腫瘍浸潤T細胞の改良技術構築と難治性がんを標的としたキメラ抗原受容体T細胞療法の新規開発
- 研究所:腫瘍免疫応答研究分野、腫瘍免疫制御TR分野
- 病院:血液・細胞療法部、婦人科部
がん細胞を認識して攻撃できるT細胞を薬として用いる免疫細胞療法において、遺伝子レベルでT細胞を改変する独自の技術を用いて治療効果・安全性の飛躍的な改善を目指す課題。
第四の治療法として確立されつつある免疫療法の一つに、患者さんの体内のT細胞を取り出して、体外でがん細胞を効果的に認識・攻撃できるように加工・増殖させて輸注する養子免疫療法があります。特にキメラ抗原受容体(CAR)と呼ばれる、がん細胞を認識・攻撃するための人工遺伝子を導入するCAR-T細胞療法が、一部の血液がんにおいて非常に高い治療効果を示したことから注目されています。また体内に元々存在している、がん細胞を攻撃できるT細胞:腫瘍浸潤T細胞を用いるタイプの養子免疫療法も、一部のがんで有効性が確認されています。しかし、実際には十分な治療効果が確認されているがん種は未だ限定的ですし、治療に伴う全身の免疫反応による副作用の懸念も残っています。
本研究においては、免疫学、分子生物学、生化学など様々な手法を駆使して、T細胞という言わば”生きた薬”の体内での攻撃力の向上や寿命の延長、及び副作用の低減に取り組みます。また、攻撃を受けるがん細胞やその周囲の微小環境の特徴をがん細胞のゲノム解析等を通じて炙り出し、治療が効き難い場合(耐性)の仕組みを解明し、その制御法を開発します。これら一連の基礎・臨床部門が一体となった取組みで、がんに対するキメラ抗原受容体導入T細胞療法の効果と安全性を飛躍的に高め、様々な種類のがんに対する標準治療として確立することを目指します。
4)がん情報革命プロジェクト
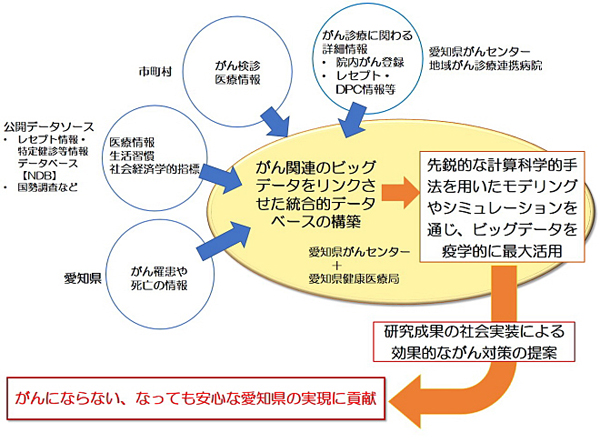
4-1)愛知県のがん対策、医療評価と将来予測のための、生活習慣情報、社会経済的情報、医療情報の連結データベースの構築と活用
- 研究所:がん情報・対策研究分野、がん予防研究分野、システム解析学分野
- 病院:呼吸器内科部、放射線治療部、消化器外科部、手術部、集中治療部、消化器内科部、内視鏡部、乳腺科部、呼吸器外科部
- 愛知県保健医療局
がん登録、院内がん登録情報、生活習慣情報、及び、社会経済的情報などのビッグデータのスパコン等を用いた情報解析を通じ、がんの将来動向予測や、予防・再発リスク低減に資する情報基盤の構築を目指す課題。
今や2人に1人ががんになり、4人に1人ががんで亡くなる時代です。がんの予防には、できるだけがんに罹らないようにする一次予防、できるだけ早期に発見し治療して治癒を目指す二次予防、再発を防止したり、社会復帰を促したりする三次予防があります。本研究では、スーパーコンピュータと最新のデータ科学的手法を駆使して、国が収集・管理してきたビックデータを解析することによって、愛知県のがん予防と医療のレベルの向上と均てん化を図るために効果的な対策の探索・同定を進めます。さらに、効果的と考えられるがん対策を進めた場合に、愛知県においてがんになったり、がんで亡くなったりする人をどのくらい減らせるのかについて、最新のモデリングとシミュレーションによって詳細な将来動向の予測を行います。
本研究を進めることによって、愛知県が、がん死亡の低減に向けて取り組む施策の立案に資する情報基盤を構築し、”がんにならない、なっても安心な愛知県”の実現へ貢献することを目指します。
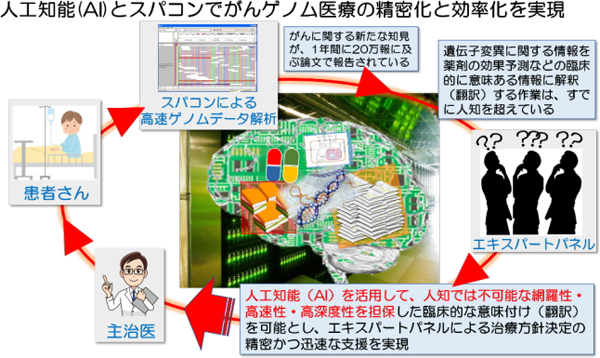
4-2)がんゲノム医療の精密化に資する人工知能を活用した情報解析基盤の構築
- 研究所:システム解析学分野、分子遺伝学分野、がん標的治療TR分野
- 病院:がんゲノム医療センター、リスク評価センター
個人のがん細胞のゲノム変異を調べ、その結果をよりよい治療法選択等へ役立てるがんゲノム医療の現場において、スーパーコンピューターと人工知能を活用し迅速なデータの解析および結果の解釈等をサポートする情報解析基盤の構築を目指す課題。
がんは細胞中のゲノム上に変異が生じ蓄積することで起こります。またがん細胞中のゲノムの変異の場所や仕方は個人ごと異なります。そして、ゲノムを計測したデータから変異を検出し、その内容を基によりよい治療法選択等へ役立てることを目指す「がんゲノム医療」の実装と研究が世界中で進められています。愛知県がんセンターは、厚生労働省指定のがんゲノム医療拠点病院として日本におけるがんゲノム医療を積極的に推進しています。
がんゲノム医療においては、ゲノムデータを解析して得られた様々な変異の意味を解釈し、薬剤の選択や予後の予測等、臨床上有用な情報へ解釈・翻訳することが、最も重要なステップの一つです。そして、その内容を議論し治療法選択などの意思決定を行う場が、「エキスパートパネル」と呼ばれる、多職種の専門家から構成される会議です。
しかしながら、遺伝子の変異は多種多様であり、それぞれの変異を有用な情報へ翻訳することは、専門家をもってしてもしばしば困難かつ大変な労力のかかる作業であり、ボトルネックとして認識されています。その背景としては膨大な文献情報が日々産生・蓄積されており、もはや人の力では情報を網羅的に整理し探索することが不可能になっていることが挙げられます。また今後、計測しうる遺伝子および非遺伝子領域からのデータは、種類も量も増大することが予想されています。
本研究では、人工知能とスパコンを活用し、これらの膨大かつ多様な計測データを、迅速に解析し、また得られた変異情報等の解釈をサポートする情報解析基盤を開発することを目指しています。また開発するデータ解析基盤は、重点プロジェクトの他の課題でも活用されていく予定です。