輸血部
令和4年3月改訂
概要
輸血部では、良質で安全な、「がん医療」の提供のため、病院各部門と協力し、「適正かつ安全な輸血療法」に必要な、下記の業務を遂行します。
- 輸血製剤の確保
- 輸血製剤の保管・管理
- 輸血検査の実施
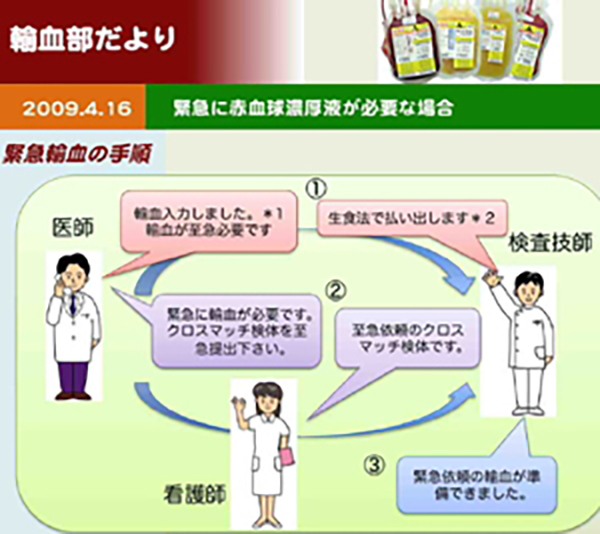
- 緊急輸血体制の確立
- 自己血輸血の推進
- 院内輸血療法の指導
- 輸血療法委員会の運営
- 造血幹細胞採取および移植への協力
- 日本赤十字血液センターとの協力

輸血療法とは
輸血療法の目的は、血液中の赤血球や血小板などの細胞成分や、血漿成分に含まれる凝固因子などの蛋白質成分が、量的に減少・機能的に低下した時に、その不足した成分を補充することにより、臨床症状の改善を図ることです。
輸血療法の原則は「成分輸血」です。成分輸血とは、目的以外の成分による副反応・合併症を防ぎ、循環系への負担を最小限にし、限られた資源である血液を有効に用いるため、全血輸血を避けて、必要な血液成分・必要量を補う輸血方法です。
特定生物由来製品とは
輸血用血液・血漿分画製剤などの医薬品は、特定生物由来製品に分類され、法律等により、(1)適正使用、(2)患者さんへの説明、(3)使用記録の作成・保存、(4)情報の提供、(5)副反応・感染症報告が定められています。
特定生物由来製品としての血液製剤
適正使用
血液製剤の適正使用は、「安全な血液製剤の安定供給の確保等に関する法律」に規定されています。人の血液に由来する感染症等の副反応のリスクを完全には排除できないため、疾病の治療上の必要性を十分に検討の上、「血液製剤の使用指針」及び「輸血療法の実施に関する指針」を参考に、適応を決定、製剤を選択し、必要最小限の使用に努めます。
患者さんへの説明
血液製剤を使用する際は、その必要性とともに感染症等の副反応等のリスクに加え、使用記録の作成・保存、遡及調査時の製造業者等への情報提供について、担当医師より、患者さん又はその家族等に説明の上、ご理解・ご同意を頂く必要があります。
使用記録の作成・保存
血液製剤を使用した場合は、その名称(販売名)、製造番号、使用年月日、患者氏名・住所等を記録し、少なくとも20年間保存することが必要です。
情報の提供等
保健衛生上の危害発生・拡大を防止するために必要であって患者さんの利益になる場合には、使用記録を製造業者等に提供します。
副反応・感染症報告
副反応・感染症が発生した場合には、保健衛生上の危害発生・拡大を防止する必要があると判断される症例について、医療機関及び薬局等の医薬関係者等が直接厚生労働大臣に報告する義務があります。
生物由来製品感染等被害救済制度について
この制度は、法律(医薬品医療機器総合機構法)に基づく公的な制度であり、生物由来製品を適正に使用したにもかかわらず、感染等によって一定レベル以上の健康被害が生じた場合に、医療費等の諸給付を行うものです。
詳細につきましては、独立行政法人医薬品医療機器総合機構のホームページ(下記)を参照ください。
業務内容
安全への取り組み輸血製剤の確保
- 「愛知県がんセンター病院 輸血マニュアル」の策定
- 院内研修会の開催(医療安全管理室・輸血部共催)
医療事故防止、特定生物由来製品としての血液製剤、輸血手順、使用指針、副反応対策に関する指導 - 「輸血部だより」の発行(下)
輸血部からの依頼事項・輸血療法に関する院内情報発信
- 輸血業務の電子化の推進
- 輸血の依頼・製剤・検査検体と患者との認証の電子化(患者誤認防止)
- 輸血実施・副反応報告のオンライン化(遡及性確保)
- 輸血関連法規の遵守
- 安全な血液製剤の安定供給の確保等に関する法律
- 血液製剤の使用指針
- 輸血療法の実施に関する指針
- 血液製剤保管管理マニュアル
- 血液製剤等に係る遡及調査ガイドライン
輸血製剤の確保
代表的な輸血製剤として、
- 赤血球:照射赤血球液-LR「日赤」(Ir-RBC-LR)2~6℃で保管、採血後28日間有効。
- 血小板:照射濃厚血小板-LR「日赤」(Ir-PC-LR)20~24℃で振とう保管、採血後4日間有効。
- 血漿:新鮮凍結血漿-LR「日赤」(FFP-LR)-20℃以下で保管、採血後1年間有効。
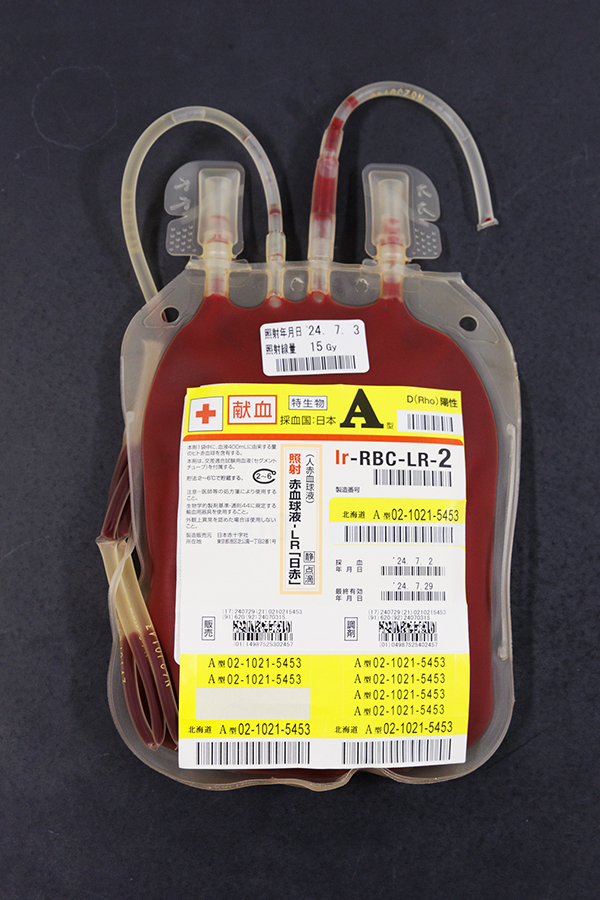
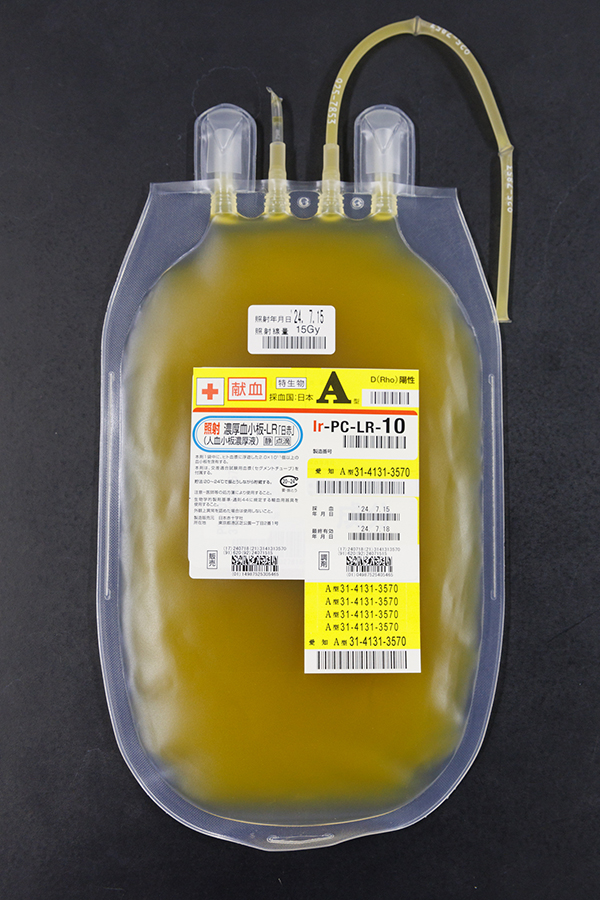

赤血球製剤は、緊急時に対応できるように一定量を、院内に保管することが可能ですが、血小板製剤は、有効期限が短いため、必要時に血液センターから供給を受けます。
輸血製剤の保管・管理
輸血製剤ごとに、適正な保管条件が定められており、当院では、輸血製剤ごとに専用の保管庫を完備しています。また、庫内温度管理、及び、異常発生時の遠隔通報装置を備えています。自己血保管庫については、保管血液の感染症の有無に応じて、別個に分けています。


輸血検査の実施
輸血検査として、血液型検査、赤血球輸血の際の交差適合試験(クロスマッチ)、不規則抗体検査、赤血球に対する感作の有無を確認する直接抗グロブリン試験等があります。
血液型検査・交差適合試験は、時間内においては、輸血部技師により、時間外においては、2001年より、臨床検査部技師の全面的協力により、24時間体制で、万全を期しています。
現在、自動輸血検査装置による検査の効率化・適正化は、必須ですが、迅速検査や不規則抗体検査など、専門的な判断・経験を要する局面においては、熟練した輸血部技師の手腕が不可欠です。


緊急輸血体制の確保
予見不能かつ不可避な状況として、危機的大量出血などが生じた場合、患者さんの救命を優先して、現場医療スタッフとの連携を緊密に行い、可能な限り、輸血製剤の確保に努めます。
危機的大量出血に対して、日本麻酔科学会と日本輸血・細胞治療学会による合同ガイドライン「危機的大量出血への対応ガイドライン」に準拠し策定した、院内「緊急初動対応マニュアル」に沿って、輸血部として対応します。
院内における輸血療法の指導
当院は、輸血管理料算定の施設基準を満たしており、院内研修会・輸血療法委員会・「輸血部だより」などの刊行物により、「適正かつ安全な輸血療法」の普及に努めます。輸血部の日本輸血・細胞治療学会認定医が、院内の輸血療法に関するコンサルテーションに対応します。
輸血療法委員会の運営
病院の各部門の実務担当者と、医療安全管理室・運用部と共同して、輸血業務に関して、課題・問題点を提起し、その改善に努めています。 また、輸血マニュアルの改訂・オーダリングシステムの改善について、積極的な立場にあります。
造血幹細胞採取および移植への協力
血液・細胞療法部の要請に応じて、造血細胞移植学会ガイドラインに基づき、人工透析等の体外循環の専門技能を有する、臨床工学技士が、血液成分分離装置を用いた自家及び同種末梢血幹細胞採取を行い、輸血部にて分離・保管・払出を行っています。
輸血部において、院内にて調製した移植用幹細胞バッグの他、当院の移植予定患者のため、さい帯血バンクより提供を受けた移植用幹細胞バッグも、専用の超低温冷凍庫にて保管します。


日本赤十字血液センターとの協力
輸血に関する情報収集・輸血副反応の原因究明の他、抗HLA抗体などの特殊な輸血検査や、稀な血液型の輸血製剤の供給など、臨床的要請に応じて、日本赤十字血液センターと密接に連携しています。
患者さんへのメッセージ
患者さんへのお願い
「適正かつ安全な輸血療法のために」、患者さんに、下記の点につきまして、ご理解・ご協力をお願い致します。
輸血療法の説明同意書について
患者さんに対して、特定生物由来製品の原材料に由来する感染症のリスクと、血液製剤の有効性・安全性・適正使用のために必要な事項について、説明の後に、十分内容をご理解頂いた上で、同意書に、ご記名頂きますよう、お願い致します。
患者さんの血液型確認
当院において、初めて血液型(ABO・Rh型)検査を実施した場合は、その結果を患者さんにお伝えします。最初の輸血までに、原則として2回血液型検査を実施し、同じ結果であることを確認します。
患者さんと輸血製剤との確認
患者さんに、適正かつ確実に輸血を行うため、輸血に際して、医師の指示内容・輸血製剤・患者さんを認証します。認証には、電子認証(入院患者リストバンド・外来患者スケジュールのバーコードと輸血製剤のバーコードの符合)と、マニュアル認証(輸血伝票・電子カルテ血液型・輸血製剤ラベルについて、医療スタッフによる確認)を併用します。
更に、ベットサイドにて、輸血の開始時に、患者さんに、氏名・生年月日・血液型をお尋ねします。お手数ですが、正しい治療を受けるため、必要な手順ですので、必ず返答くださいますよう、ご協力ください。(なお、手術中など、患者さん自身が返答できない場合は、複数の医療スタッフで確認しますので、ご安心ください。)

輸血副反応について
輸血開始後数分から生じるおそれがある、「じんましん」などのアレルギー反応等の副反応の他に、まれに、輸血終了後数時間を経てから、息苦しさなどの症状で発症する副反応(輸血関連急性肺障害など)も生じうるため、注意が必要です。
輸血開始時・施行中・終了直後は、必ず、看護師等が体調の確認を行いますので、体調異常を感じた場合は、遠慮なく速やかに、お知らせください。
感染症のリスクに対する取り組み
血液製剤の安全性向上の取り組みとして、日本赤十字社では、(1)献血受付時の問診、(2)献血血液の感染症検査(血清学的検査・核酸増幅検査)、(3)原料血漿の貯留保管等により、輸血に伴う感染症のリスクを減らすよう努めています。
万一の患者さんへの感染に備え、初回輸血前に、B型肝炎ウイルス・C型肝炎ウイルス・HIVに関して血液検査を行い、医療上必要に応じて、感染症の再検査を行います。また、輸血検査の検体の一部を輸血部にて凍結保管し、遡及調査時の再検査を行うために使用します。
自己血輸血の推進
適正な実施管理体制のもとでは、同種血輸血(他人からの輸血)に比べ、自己血輸血は、安全性の高い輸血療法です。主に、輸血を必要とする、待機的外科手術において、貯血式自己血輸血を、積極的に推進します。
手術内容・スケジュールや、患者さんの体調により、自己血輸血の対象とならない場合もありますので、担当医師にご相談ください。
業務実績
血液使用量(単位)
| 製剤種/年度 | 2019 | 2020 | 2021 | 2022 | 2023 |
|---|---|---|---|---|---|
| 自己血液 | 22 | 14 | 10 | 10 | 12 |
| 赤血球製剤 (赤血球液等) | 5,026 | 4,558 | 4,340 | 4,254 | 5,338 |
| 凍結血漿 | 1,094 | 1,600 | 1,196 | 1,108 | 1,058 |
| 血小板製剤 (濃厚血小板) | 9,335 | 7,495 | 7,895 | 7,205 | 11,300 |
検査件数(件)
| 検査項目/年度 | 2019 | 2020 | 2021 | 2022 | 2023 |
|---|---|---|---|---|---|
| 交差適合試験 | 2,701 | 2,456 | 2,242 | 2,277 | 2,829 |
| 血液型(ABO・Rh) | 8,825 | 8,931 | 8,912 | 9,663 | 9,943 |
| 抗体スクリーニング | 8,821 | 8,928 | 8,909 | 9,662 | 9,942 |
- 成分製剤は血液200mlに由来する成分を1単位とする。
- 血液型(ABO・Rh)については2013年度より集計方法を変更した。
ISO15189 認定取得
当センターにおいて、輸血部は、臨床検査部と遺伝子病理診断部と共に、輸血検査業務を含む臨床検査の国際規格「ISO 15189(臨床検査室-品質と能力に関する特定要求事項)」に基づき審査を受け、2018年3月15日にISO 15189の認定を取得しました。
臨床検査室認定(ISO 15189)とは、臨床検査(一般検査、血液学的検査、生化学的検査、免疫学的検査、微生物学的検査、病理学的検査など)を実施する臨床検査室の技術能力を決定する手段の一つです。ISO 15189は、「品質マネジメントシステムの要求事項」と「臨床検査室が請け負う臨床検査の種類に応じた技術能力に関する要求事項」の2つから構成されています。アジア太平洋試験所認定協力機構(APLAC)の相互承認に基づき、ISO 15189の認定を受けた臨床検査室の検査報告書は、国際的にも通用します。
厚生労働省の定める施設基準・学会認定施設 等
厚生労働大臣が定める施設基準の届出
- 輸血管理料I 算定開始日:2009年5月1日~
日本輸血・細胞治療学会 認定医制度に係る指定施設
- 初回認定日:2004年4月1日
日本適合性認定協会 ISO15189(2012)
- 初回認定日:2018年3月15日

