膵がん
膵がんとは
膵臓は淡黄色の細長い臓器で、長さ15cm、幅3-5cm、厚さ2-3cm、重さ60-70gです。膵臓はみぞおちの奥、すなわち胃のちょうど背中側で、上方は肝臓、下方は横行結腸、後方は大血管と左腎、右方は十二指腸、左方は脾臓に囲まれ、さらには様々な血管にも取り囲まれています(図1)。膵臓の主な働きは食べ物の消化と血糖値の調節であり、膵臓は消化液(外分泌)とホルモン(内分泌)を分泌する体内の唯一の臓器です。膵臓を構成する細胞には、消化酵素を産生・分泌する腺房細胞、消化酵素を十二指腸へ運ぶとともに、十二指腸に流入した胃酸を中和するアルカリ性の膵液を分泌する膵導管細胞、血糖を下げるインスリンや上昇させるグルカゴンなどのホルモンを産生するランゲルハンス島があります。膵臓をブドウに例えると、消化酵素を分泌する腺房はブドウの房、膵液を分泌する導管は茎に相当します。ランゲルハンス島は膵臓のなかに浮かんでいます(図2)。
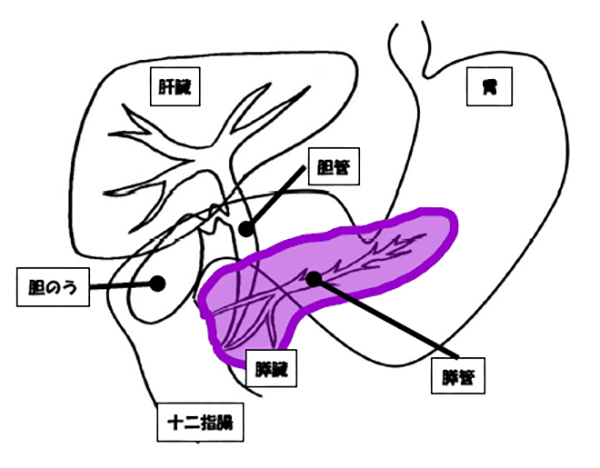
がんはこれらの各々の細胞から発生しますが、通常膵がんと呼ばれるものは膵管上皮(膵導管細胞)から発生します。その割合は80-90%を占め、残りは腺房細胞癌、神経内分泌腫瘍などです。ここでは膵管上皮から発生する膵がんについて解説をしていきます。
膵がんの患者さんは年々増加しており、国立がん研究センターがん情報サービスの最新がん統計では、日本国内で現在年間約4万人以上の患者さんが罹患しています。2018年の膵がんによる死亡数は35,390人で、部位別がん死亡数で膵がんは、男性では肺、胃、大腸に続き第4位、女性では大腸、肺に続き第3位でした。他の部位のがんに比べ、罹患数に対する死亡数の割合が極端に高い(罹患数と死亡数がほぼ同数)のが特徴で、死亡数では順位が高くなっています。膵がん死亡の増加の原因は人口構成が高齢化したことが最も大きい要因ですが、膵がんに対する有効なスクリーニング検査法がなく、高危険群(ハイリスクグループ)の設定が難しいことなどです。
最近の研究によって、少しずつ膵がんのハイリスクグループがわかってきました。膵がんのリスクファクターとして明らかになっているのは、膵がんや遺伝性膵がん症候群などの家族歴、糖尿病、慢性膵炎や膵のう胞、遺伝性膵炎などの合併症、喫煙などの嗜好が挙げられています。膵がんに罹患した第一度近親者(親子や兄弟姉妹)が2人以上いる家系を家族性膵がん家系といいます。膵がん患者数が多くなれば膵がん発症リスクが高くなると言われています。遺伝性膵がん症候群は「特定の原因遺伝子により家系内で膵がんが多発する疾患群」とされています。
膵がんが身内にある方、糖尿病と初めて診断された方やコントロールが悪くなった方、膵炎や膵のう胞と診断された方は病院で検査を受けることをお勧めします。近年、膵のう胞患者さんの膵がん発生リスクに注目が集まっています。膵のう胞は膵癌の高危険群になります。当院では全国的にも珍しい膵のう胞に対する専門外来(膵のう胞外来)を開設しています。膵がんの早期発見のために膵のう胞と診断された患者さんに対して定期的な診察と検査を行っています。
膵がんの症状
自覚症状は初期には無症状か上腹部不定愁訴など、何となくお腹がおかしいと感じることが多いようです。進行すると上腹部痛、背部痛、黄疸、お腹にしこりを触る、末期になれば吐血、下血、腹水などが現れます。膵癌全国登録によると無症状で発見されることは15%程度であり、その多くは有症状であるといわれています。発症時の症状としては、腹痛(31.6%)が最も多く、黄疸(18.9%)、腰背部痛(8.6%)、体重減少(4.7%)と続きます。
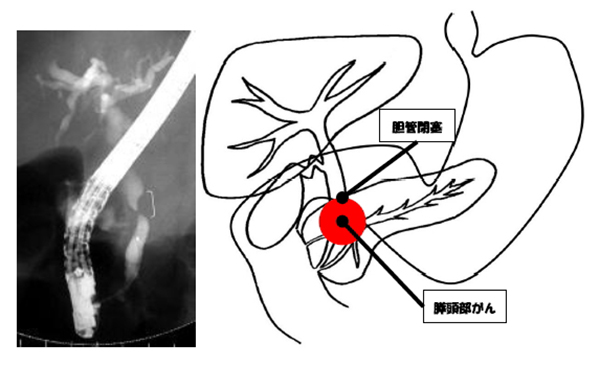
また、症状はがんの発生部位によって変わります。膵がんの発生部位は膵頭部が65%と最も多く、主膵管が閉塞すると膵液のうっ滞や二次性膵炎が起こるため、心窩部痛、上腹部痛や背部痛などの症状が出現することがあります。腫瘍マーカーが正常値でも、血中膵酵素(アミラーゼやエラスターゼなど)の上昇がみられることがあります。これは膵がんの比較的早期にみられ、早期発見できれば膵がんが治る可能性が高くなります。しかし、多くの患者さんの症状は軽微なため、病院を訪れることなく、進行した状態で発見されることが多いのが現状です。病気が進行すると持続的な腹痛や頑固な背部痛が出現します。主膵管の閉塞は膵外分泌能を低下させ食物の消化吸収を障害し、下痢、腹痛、体重減少などを生じることがあります。また、内分泌機能が障害されると口渇、多飲、多尿などの糖尿病の症状があらわれます。癌が膵臓の外にでると近傍の胆管を閉塞させ(図3)黄疸が生じ、眼が黄色くなったり、尿が濃い紅茶色に変化します。肝臓機能の悪化が見られ、血中ビリルビン、ALP、γ-GTP、AST(GOT)やALT(GPT)などが上昇します。病巣が進展し十二指腸を狭窄させると、悪心、嘔吐などの症状が現れます。膵体部がんあるいは膵尾部がんでは解剖学的位置関係から前述した症状が出るまでに時間がかかります。がんが進行すると、腹水が貯留したり、神経を圧迫して持続的な背部痛が生じたり、食欲不振が続いて体重減少などがおこります。膵尾部がんでは血液検査の異常でみつかることは少なく、また超音波検査でも指摘が難しい場合があり、発見が遅れることが多いです。
膵がんの診断
血清膵酵素
膵がんによって膵液の流れ道である主膵管が狭窄する(図1)と、血液中にアミラーゼやエラスターゼIといった膵臓から分泌される消化酵素が20-30%の患者さんで上昇します。いずれも膵がんに特異的ではなく、急性膵炎や慢性膵炎でも上昇をきたすため、確定診断には必ずしも有用ではありませんが、発見の契機になることがあります。また上述したように、膵頭部がんでは胆管が狭窄すると肝機能障害を呈することがあります。
腫瘍マーカー
膵がんで上昇する代表的な腫瘍マーカーにはCA19-9、CEA、Dupan-2などがあります。膵がん患者さんにおける各腫瘍マーカーの陽性率はCA19-9が70-80%、CEAは55-62%、Dupan-2では48%と報告されていますが、最も感度の高い腫瘍マーカーであるCA19-9でも2cm以下の比較的小さな膵がんでの陽性率は50%程度であり、また胆石などによる胆汁うっ滞でも上昇することがあります(偽陽性)。一方、日本人の10%程度はLewis A抗原陰性であり、そのような患者さんではたとえ進行した膵がんでもCA19-9が上昇しないこと(偽陰性)があり注意が必要です。CEAも同様に全ての膵がん患者さんで陽性となる訳ではなく、また胃、大腸、肺など他のがんや良性疾患、喫煙などでも陽性となり、膵がんに特異的ではありません。腫瘍マーカーの陽性率は進行がんを除けば低く、現存する腫瘍マーカーでは残念ながら膵がんの早期発見には有用ではありません。むしろCA19-9では、膵がんの術後の再発診断や化学療法などの治療効果を判断するのに有用と考えられています。
画像検査
臨床症状や血液検査、腫瘍マーカー、危険因子などから膵がんが疑われたら、次に画像検査を行います。腹部超音波検査(エコー)、CT、MRI、PETなどを組み合わせて施行しており、さらに異常を認めた場合やハイリスク症例では超音波内視鏡(EUS)や内視鏡的逆行性膵管造影(ERP)をおこないます。
腹部超音波検査は、手軽にでき、身体的負担をほとんどかけないのが利点です。健康診断などで施行されることも多く、早期発見のきっかけになることもあります。しかし体格の良い方、上腹部の手術を受けた方や慢性膵炎の患者さんなどでは膵臓が見えにくいこともあります。
CTは膵臓や周囲の臓器が明瞭に描出され、膵がんの診断に有用です。特にがんのひがりを診断し、手術の可否を判定するには優れた方法です。しかし、CTをもってしても早期膵がんの発見が困難な場合も珍しくありません。また、放射線被曝、造影剤による副作用の問題があります。また膵炎と膵がんの鑑別が難しい場合もあるなど、CTにも限界があります。
MRIは、CTと同様な診断法ですが、放射線被曝がないのが特徴です。またMRIを用いて膵管・胆管を描出(MRCP)することもでき、次に述べる内視鏡的逆行性胆管膵管造影(ERCP)に比べて低侵襲(患者の負担が軽い)です。
ERCPは、内視鏡を十二指腸まで挿入し、膵管に細いカテーテルを入れて造影剤を注入し膵管を描出する検査法です。膵液を採取して細胞の検査(細胞診)を行うこともできます。急性膵炎などの合併症が欠点であり、近年では非侵襲的におこなうことのできるMRCPの普及や、組織診断としての超音波内視鏡下穿刺吸引法が定着してきているため、ERCPの役割は変化してきています。超音波内視鏡で腫瘤が確認できず膵管だけに変化のある症例などにおいて、細胞診を得るための検査として施行しています。
PETはがん細胞が糖分を多く消費することを利用した検査法です。全身の検査が一度にできる利点があり、膵がんの発見にも有用な場合があります。しかし、正常組織でも陽性になったり、小さな膵がんは検出できないことがあるなど、やはり限界があるのが現状です。
超音波内視鏡(EUS)は、内視鏡の先端に超音波端子を備えた内視鏡です。とくに2cm以下の小さな膵がんの検出には最も信頼性の高い検査法であり、他の検査では腫瘤が描出されなかった場合でも、容易に発見できることがあります。当センターは、日本における超音波内視鏡(EUS)の先駆的施設であり、積極的に施行しています。
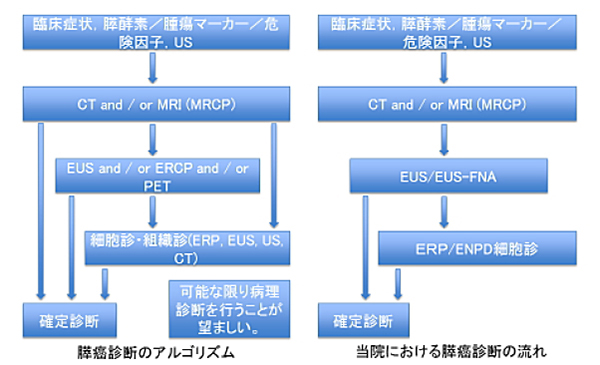
健診や腹痛・腰背部痛・黄疸・体重減少、糖尿病新発症や糖尿病の悪化などではまず非侵襲的な検査からおこない、膵がんが疑われる場合にはさらに画像検査を追加します。
病理検査
胃、食道、大腸などの消化管(胃腸)のがんの確定診断には、内視鏡を行う際に病変の組織を採取(生検)し、顕微鏡でがん細胞を確認します(病理診断)。一方膵がんでは、通常はCT(あるいはMRI)、EUS、ERCP(膵管と胆管の造影検査)、PETなどの画像検査を行い総合的に判断します。しかし、画像検査で膵がんと診断されて手術した患者さんの5-10%では実際に膵がんではないとの報告もあり、膵がんでも病理診断が必要となります。膵がんに対する病理検査の方法としては、ERCP時に行う膵液細胞診、USあるいはCTガイド下の経皮的生検、術中の生検などがあります。しかしERCP下の膵液細胞診での陽性率は50%前後と低く、USガイド下生検での陽性率は74-87%、CTガイド下生検では78-98%ですが、がんの大きさや発生する場所により成績が大きく異なること、痛みや出血などの合併症、CTガイド下生検では放射線被曝などの問題が残されています。また術中生検では、全身麻酔を行い、開腹術を行わなければならず、患者さんに大きな負担がかかります。当院では、超音波内視鏡(EUS)を利用して膵臓の腫瘤を観察しながら、安全に針生検を行うように努めています。(超音波内視鏡下穿刺吸引生検法, endoscopic ultrasound-guided fine needle aspiration; EUS-FNA)。超音波内視鏡下穿刺吸引生検法の適応はUS、CT、EUS等で膵腫瘍が疑われた患者さんです。EUS-FNAによる膵がんの陽性率は約95%とされており、確実な検査方法といえます。消化管穿孔や出血、膵炎などの合併症がありますが、頻度は1%以下と報告されています。またがんが針を介して広がる播種の報告がありますが、世界的にみてもその報告は稀であると言えます。当院では正確な診断に基づく正確な治療を基本方針としているため、積極的な病理診断を得るように努力しています。診断が間違えば、治療も間違えてしまいます。正確な病理診断を得ることが、治療を行う上で最も重要であると考えています。
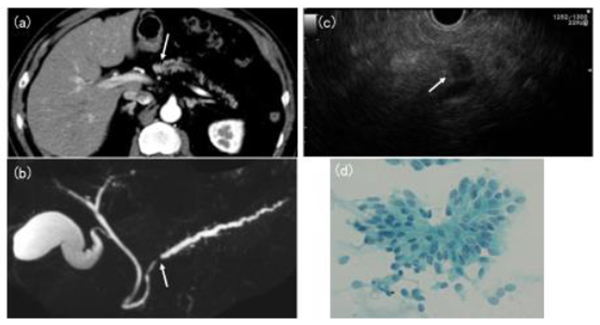
c:EUSでは7mm大の腫瘤を描出することができEUS-FNAをおこない、細胞診で膵癌の診断を得ることができました。
また、後述するがん遺伝子パネル検査が保健収載されたことにより、腫瘍組織の遺伝子異常を調べることで適切な治療法を検討することができるようになりました。この検査を行うためには、これまでの病理組織検査よりも多くの組織を採取する必要があり、当院では使用する針の選択や、穿刺法などに工夫をして、十分な組織採取ができるように努力をしています。
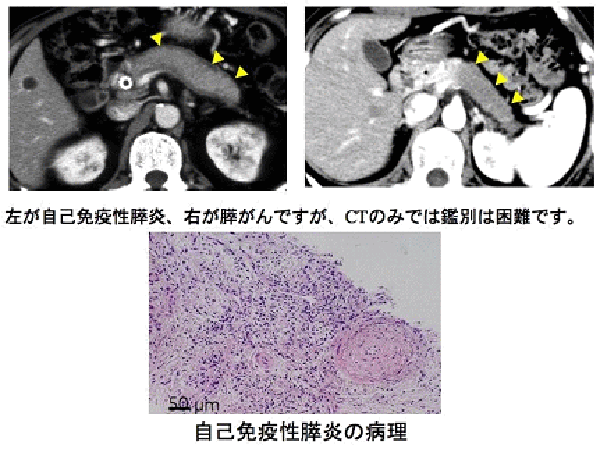
さらに、高齢男性に好発し、ステロイド治療によく反応する特殊な膵炎である自己免疫性膵炎の場合、CTなどの画像検査では鑑別が困難なことも多く、これまでには膵がんと間違って診断され手術や化学療法をされてしまう症例がありました。そのような場合には、EUS-FNAを用いた病理診断は大変重要となります。
がん遺伝子パネル検査
がん遺伝子パネル検査とは、がん細胞の特徴をゲノム解析によって網羅的に調べ、がんと関連する多数の遺伝子の状態を確認することを通して、がんの特徴を調べ、適切な薬剤や治療法、参加できる可能性のある臨床試験や治験の有無を専門家チームが検討し、その結果をお伝えする検査です。現在保険診療で実施可能な検査には、FoundationOneR CDxがんゲノムプロファイルとOncoGuide?NCCオンコパネルシステムの2つの検査があります。手術や生検で採取したがんの一部(腫瘍組織)を用いて検査をします。
膵がんの病期(ステージ)
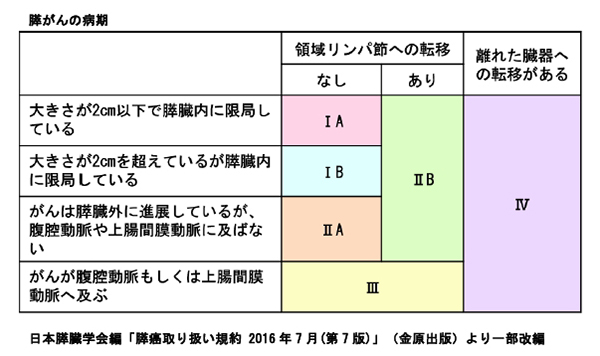
膵がんの進行度(ステージ)は大きさ、前方、後方、門脈、大きな動脈、十二指腸、胆管などへの浸潤、リンパ節転移、遠隔転移などの有無により規定されます。日本膵臓学会では4段階(StageI~IV)に分けています。Stageの判断は主にCTなどによって行いますが、PETを併用することもあります。国際的なステージ分類にはUICCがあります。
膵がんの治療法
治療法の選択は、Stageによって決定していきます。治療の場面では、切除可能かどうかによって膵臓がんを「切除可能膵臓がん」と「切除不能膵臓がん」に分け、切除不能膵がんはさらに遠隔転移の有無により「局所進行膵がん」と「転移性膵がん」に分けて検討します。病期分類とこれらの病態との間にはおおよそ以下のような関係があります。
| 切除可能膵臓がん | 局所進行膵臓がん | 転移性膵臓がん | |
|---|---|---|---|
| 日本膵臓学会 UICC | Ⅰ〜Ⅱ | Ⅲ | Ⅳ |
2016年には、上記の「日本膵臓学会 膵癌取扱い規約」の中で、「切除可能性分類」が新たに定義され、「切除可能」「切除可能境界」「切除不能」の3つの分類が定められました。切除不能の場合、患者さんの体力に応じて化学療法を選択しますが、病状が随分進行し体力的に化学療法に耐えられない場合は、症状などの緩和を中心としたbest supportive care(BSC)を選択するかを判断します。
1)手術(外科治療)
膵がんの治療の中で、最も治療効果が高く根治が可能なものは手術です。手術ができる場合には、がんを含めて膵臓と周囲のリンパ節などを摘出します。2016年に「日本膵臓学会膵癌取扱い規約」の中で、上述したように「切除可能性分類」が新たに定義され、CT検査などの所見を総合した結果から、「切除可能」「切除可能境界」「切除不能」の3つの分類が定められました。手術が適応になるかは、肝臓や肺などの遠隔転移がないかどうか、重要な臓器に栄養を運ぶ血管にがんが広がってないか、などから判断されます。
「切除可能境界」は、遠隔転移はないものの、がんが主要な血管に広がっているものを指します。がんが動脈系(上腸間膜動脈、腹腔動脈、総肝動脈)まで広がっているか、門脈系への浸潤にとどまっているかによってさらに細分されます。いずれも、標準的手術のみでは、がんが組織学的に残存する可能性が高いとされており、個別の状況に応じた治療法が検討されます。当院では、消化器内科部・消化器外科部・放射線診断IVR部・東名古屋画像診断クリニックPETセンターが合同でカンファレンスを施行し、術式や治療方針の決定をおこなっています。
膵頭十二指腸切除術
膵頭部(膵臓の右側)にがんがある場合に膵頭十二指腸切除術を行います。膵頭部、胃の一部、十二指腸、小腸の一部、胆のう、胆管を摘出します。膵臓の周囲のリンパ節、脂肪、神経なども一緒に摘出します。摘出したあとは、残った膵臓と小腸、胆管と小腸、胃と小腸の順につなぎ直し膵液、胆汁、食べ物の通る経路をつくります。
膵体尾部切除術
膵臓の体部・尾部(膵臓の左側)にがんがある場合には膵体尾部切除術を行います。膵臓の左側と脾臓を一緒に摘出します。
膵全摘術
がんが膵臓全体に及ぶ場合は膵全摘術が行われます。ただし、膵全摘を行うと、膵臓の機能がなくなるため、術後には血糖をコントロールするためにインスリンの注射が必要となります。また、膵酵素も補充する必要があります。
バイパス術
がんが進行して食べ物の通り道である十二指腸が閉塞している場合には、がんの摘出ができなくても食べ物の通り道を作るために胃と小腸をつなぐバイパス手術を行うことがあります。
2)化学療法(抗がん剤治療)
血管を巻き込んでいて手術ができない場合(局所進行膵臓がん)や肝臓や肺、腹膜などの遠く離れた臓器に転移している場合(転移性膵臓がん)、また手術後に再発した場合には、化学療法(抗がん剤治療)をおこないます。化学療法には、生存期間を延長する効果や疼痛などの症状を和らげる効果があります。
現在、膵がんに対して最初に行われる化学療法(一次化学療法)は以下のものがあります。
FOLFIRINOX療法(フルオロウラシル(5-FU)+レボホリナート+イリノテカン+オキサリプラチン)
4剤の点滴薬を用いる方法です。オキサリプラチン、イリノテカン、レボホリナート、フルオロウラシルを使用し、その後続けてフルオロウラシルを46時間持続投与します。2週間ごとを1コースとし繰り返します。胸部などの太い静脈にカテーテルとポートを埋め込んで薬剤を投与します。初回は入院で実施しますが、その後は外来通院で実施します。
イリノテカンの代謝に関わる遺伝子多型としてUGT1A1があり、重い副作用がおこりやすいかを投与の前に検査で確認が必要です。
ゲムシタビン(ジェムザール)+ナブパクリタキセル(アブラキサン)併用療法
2剤の点滴薬を用いる方法です。週に1回点滴をおこないます。3週続けておこない4週目はおやすみです。これを1コースとし繰り返します。外来通院で実施します。
ゲムシタビン単剤治療
1剤の点滴薬を用いる方法です。週に1回点滴をおこないます。3週続けておこない4週目はおやすみです。これを1コースとし繰り返します。外来通院で実施します。
ゲムシタビン+エルロチニブ(タルセバ)併用療法
ゲムシタビンの点滴薬に加えて、タルセバを内服する方法です。ゲムシタビンは週に1回点滴をおこないます。3週続けておこない4週目はおやすみです。エルロチニブは休みなく1日1回連日飲み続けます。ただし遠隔転移のない「局所進行膵がん」にはお勧めできません。外来通院で実施します。
S-1(ティーエスワン)※単剤療法
1日2回朝・夕にS-1を内服します。標準治療は、4週間続けて内服し2週間休薬します。外来通院で実施します。
体調が良好な場合、またFOLFIRINOX療法またはゲムシタビン+ナブパクリタキセル併用療法を検討します。特にではFOLFIRINOX療法では75歳までを目安にしています。一方、体調が不良の患者さん、高齢の患者さんではFOLFIRINOX療法やゲムシタビン+ナブパクリタキセル併用療法では副作用が強くでる可能性が高まるため、ゲムシタビン単独療法やS-1単独療法を選択します。
副作用の程度や状態により投与量の変更やスケジュールの調整をおこないながら化学療法を施行します。がんに対する効果が不十分である場合には薬剤の変更をおこないます。
現在では、診断時には切除不能膵がんであっても、化学療法が奏功することで、化学療法施行後に手術をおこなえるケースもあります。
遠隔転移のある膵がんに対する主な治療法の成績
| ゲムシタビン1, 2 | FOLFIRINOX1 | ゲムシタビン/ ナブパクリタキセル2 | |
|---|---|---|---|
| 生存期間中央値(月) | 6.7-6.8 | 11.1 | 8.5 |
| 無増悪生存期間中央値(月) | 3.3-3.7 | 6.4 | 5.5 |
| 奏効割合(%) | 7.2-9.4 | 31.6 | 23.0 |
奏効割合:がんが一定程度以上小さくなった患者さんの割合
(1: Coroy et al. N Engl J Med 2011, 2: Von Hoff et al, N Engl J Med 2013より引用)
ただし、FOLFIRINOX療法とゲムシタビン+ナブパクリタキセル併用療法を直接比較した研究のデータは乏しく、どちらがより生存期間を延長するかは現時点では不明です。
一次化学療法の効果が不良な場合には、二次化学療法を行うことが推奨されています。具体的には、一次化学療法でゲムシタビンを使用した場合には、二次化学療法ではフッ化ピリミジン系抗がん剤を含む治療を提案されます。特に、フルオロウラシル+レボホリナート+イリノテカン塩酸塩水和物リポソーム製剤(オニバイド)併用療法は第3相試験で有効性が示され、日本でも承認されました。
イリノテカン塩酸塩水和物リポソーム製剤の治療成績
| FF | nal-IRI | FF/nal-IRI | |
|---|---|---|---|
| 生存期間中央値(月) | 4.2 | 4.9 | 6.1 |
| 無増悪生存期間中央値(月) | 1.5 | 2.7 | 3.1 |
| 奏効割合(%) | 1 | 6 | 16 |
nal-IRI:イリノテカン塩酸塩水和物リポソーム製剤
無増悪生存期間:治療開始からがんが進行せず安定している期間
奏効割合:がんが一定程度以上小さくなった患者さんの割合
(Wang-Gillam, et al. L ancet 2016より引用)
一次化学療法でフッ化ピリミジン系抗がん剤を使用した場合には、二次化学療法ではゲムシタビンを含む治療を提案されます。また、膵がん患者さんでの頻度は高くはありませんが、遺伝子検査でマイクロサテライト不安定性が高い(MSI-H)患者の場合であればペムブロリズマブが提案されます。膵がん患者さんでの頻度は極めて低いですが、遺伝子検査でNTRK融合遺伝子がある患者さんに対しては、エヌトレクチニブが提案されます。
手術が可能な膵がん患者さんに対する化学療法
最近では手術に先だって化学療法(術前化学療法)を行うことで治療成績がさらに向上することが示され、患者さんの状態や年齢にもよりますが、術前化学療法が積極的におこなわれています。
術前化学療法としては、ゲムシタビンとS-1の併用療法を行います。具体的にはゲムシタビンは週に1回点滴を行います。2週続けて行い3週目は休みます。S-1は1日2回朝・夕に内服します。2週間続けて内服し1週間休みます。これを1コースとして、術前化学療法では2コース行います。
術前化学療法の治療成績
| 直接手術 | 術前化学療法(GS療法) | |
|---|---|---|
| 生存期間中央値(月) | 26.6 | 36.7 |
| 2年生存割合(%) | 52.5 | 63.7 |
(Unno, et al. 2019 Gastrointestinal Cancer Symposiumより引用)
手術でがんを取り除いた場合でも、一定期間の化学療法をおこなうことにより、再発を抑制し、生存期間を延長する効果があるため、手術後の化学療法も行われるようになりました。このような治療を術後補助化学療法と呼びます。術後化学療法としては、一般的に以下の治療を行います。
- S-1(ティーエスワン)※単剤療法
- ゲムシタビン単剤治療
術後補助化学療法の治療成績
| ゲムシタビン | S-1 | |
|---|---|---|
| 5年生存割合(%) | 24.4 | 44.1 |
| 生存期間中央値(月) | 25.5 | 46.5 |
| 無再発生存期間中央値(月) | 11.3 | 22.9 |
(Uesaka et al. Lancet 2016より引用)
3)化学放射線療法
明らかな遠隔転移はないものの、血管を巻き込んでいるなどの理由で手術ができない局所進行膵臓がんに対しておこなわれることがあります。化学療法と組み合わせることが多く、その場合は化学放射線療法と呼ばれます。最近では、有効な薬物療法の出現により放射線治療の頻度が減少しています。
黄疸に対する治療
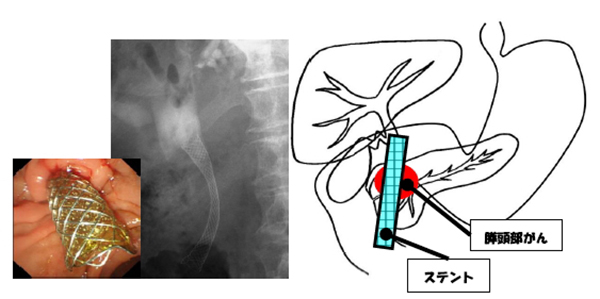
膵がんの15%程度に黄疸がみられます。特に膵頭部がんでは腫瘍による胆管の狭窄による閉塞性黄疸をおこします。また、膵体部がんや尾部がんでも腹膜播種による胆管狭窄をおこすことがあります。胆汁の流れが悪くなると閉塞性黄疸が起こります(図3)。また、うっ滞した胆汁に細菌が感染すると急性化膿性胆管炎がおこります。急性化膿性胆管炎は発熱や悪寒戦慄を伴います。黄疸や胆管炎があると手術や化学療法などの治療に際する危険性が増すため、黄疸を解除する処置が必要となります。閉塞性黄疸を解除する治療は胆道ドレナージと呼ばれます。胆道ドレナージには、皮膚から肝臓を介して胆管にアプローチする方法(経皮経肝胆道ドレナージ:PTBD)と内視鏡的に胆管にアプローチする方法があります。患者さんの全身状態に応じて、適切な方法を選択していますが、通常は内視鏡的な方法を選択することが多く当科でも積極的におこなっています。内視鏡的な胆道ドレナージには2種類の方法があります。内視鏡下経乳頭的胆道ドレナージ術は胆管狭窄に伴う閉塞性黄疸に対して現在広く行われています。しかし、急性膵炎等の合併症の問題があり、当院では超音波内視鏡下胆管ドレナージを積極的に行なっています。急性膵炎の合併症がなく、十二指腸狭窄例に対しても施行可能であり、切除不能な悪性化部胆管狭窄に対しては当科では第一選択で施行しております。この方法を用いると、他院では治療が困難であった黄疸の患者さんでも治療が可能になる場合がありますので、ご希望の患者さんは当センターまでご相談ください。
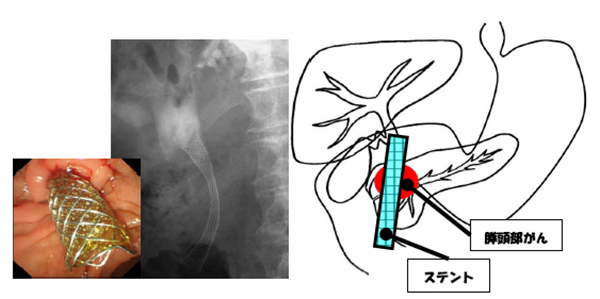
膵頭部がんによる胆管閉塞に対して、内視鏡を用いて十二指腸乳頭部から胆管にステントを留置しています。胆管閉塞部を超えてステントを留置することで、ステントを通して胆管閉塞部よりも上流にうっ滞した胆汁が十二指腸に流れることで、黄疸が改善します。
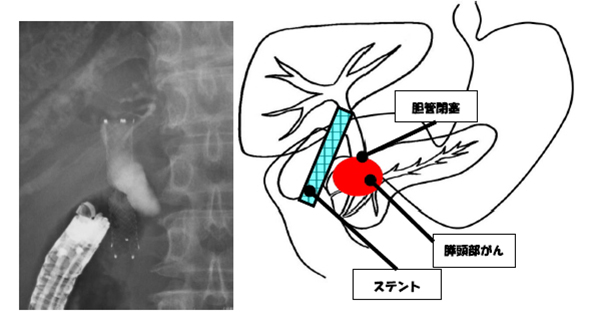
膵頭部がんによる胆管閉塞に対して、超音波内視鏡を用いて胆管にステントを留置しています。十二指腸から閉塞部位よりも上流の胆管を針で刺し、そこからステントを挿入します。十二指腸乳頭部および胆管閉塞部を通さずにステントを留置します。
膵がんの治療成績(予後)
膵がんの根治治療は手術ですが、手術ができるのは患者さん全体の20%程度と言われています。膵がんの切除後の成績も満足できるものではなく、外科切除できた患者さんでも5年生存率は10-20%と低く、消化器(食道、胃、肝臓、大腸)のなかでは最も不良です。これは膵がんが早期に転移・浸潤をおこすためです。膵がんに対する術後補助化学療法を行うと予後を改善することがわかり、現在は標準的治療となっています。
一方、切除不可能な場合には化学療法をおこないます。化学療法をおこなわない場合に比較すると明らかに予後は改善します。まだ多くではありませんが5年以上にわたって化学療法のみで長期生存する患者さんがいるのも事実です。また近年では、切除不可能な場合であっても化学療法によって縮小し手術が可能となるケースも出現しています。膵がん患者さん全体でみると5年生存率は5~10%と極めて低い数値ですが、現在、国内外で治療成績向上に向けた研究・臨床試験が行われています。
最後に
当科では膵がんを初めとした膵疾患に対して、質の高い医療を提供すること、患者さんに負担をなるべくかけないこと、知り得た情報は患者さん・家族と医療スタッフとが共有し治療方針を決定し治療を行うことを目標として日常診療を行っています。とくに内視鏡検査、超音波検査、あるいはそれらを合体させた超音波内視鏡検査を駆使し、消化器がんの早期診断、診断困難例の確定診断を行っています。近年では、専門外来である膵のう外来を開設し、膵がんの早期発見ができるよう慎重かつ正確な経過観察を行っています。また、手術不能な進行がんにおいては常に患者さんの状態を考慮し、他科との連携による化学療法や放射線治療を積極的に導入しています。また、国内および海外のがん専門病院と協力して化学療法の臨床試験を積極的に推進し、一般診療では使用できない新規抗がん剤の開発に参加しています。これらの治療を行いながら、がん治療の発展に貢献すべく努力をおこなっています。

