肺がん
- 肺がんを防ぐには
- 肺の構造と機能
- 肺がんとは
- 肺がんの症状
- 肺がんの診断
- 肺がんの病期(ステージ)
- 肺がんの治療法
- 臨床試験について
- 説明と同意について
- 悪性胸膜中皮腫
- 放射線治療部
- 呼吸器内科部
- 外来診療担当医一覧表
- セカンドオピニオン外来
肺がんを防ぐには
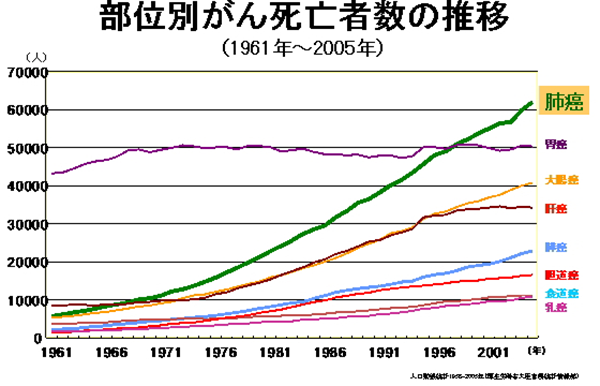
平成26年の統計では、日本人の肺がん死亡者は73,396名(男52,505、女20,891)で、全体と男性ではがん死亡原因の一位、女性でも大腸がんに次いで二位です。
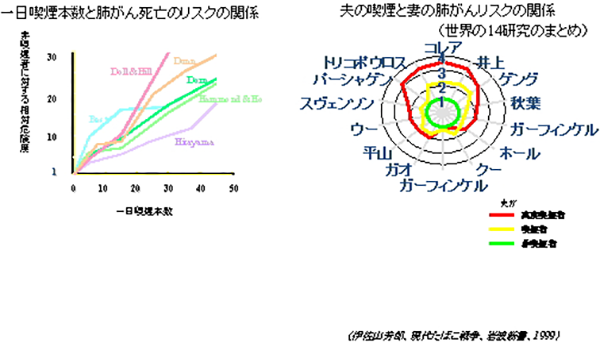
肺がんは治りにくいがんの代表であり、肺がんによる死亡を減らしていくためには、まず予防することが重要です。肺がんにならないようにする(一次予防)には、なんと言っても禁煙が重要です。日本では他の先進国と比べて男性の喫煙率が高いのが特徴です。一方、女性の喫煙率は低いのですが、近年若い女性の喫煙率が上昇していることが問題となっています一日喫煙本数×喫煙年数を喫煙指数といい、これが400以上の方は肺がんのハイリスクグループとされます。たばこの量と肺がんになる危険(リスク)には相関関係があり、一日20本吸う人は非喫煙者にくらべておよそ10倍程度肺がんで死亡しやすいことがわかります。また、最近は非喫煙者の肺がんも少なくありませんが、その際、他人の吐いたたばこの煙を吸うことによって肺がんになりやすくなることも知られています。これを受動喫煙といいますが、夫がヘビースモーカーの場合、妻の肺がんの危険は2-3倍程度上昇するといわれています。
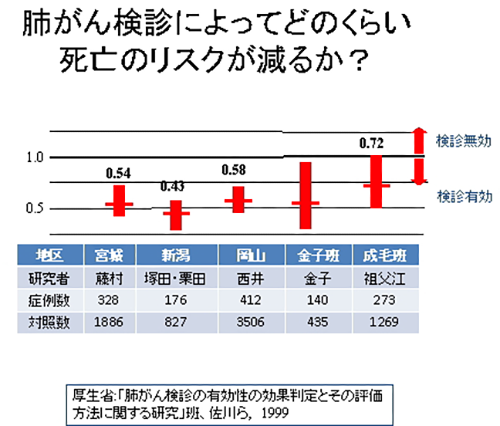
最近は、タバコを吸わない人の肺がんも少なくありません。肺がんの原因にはたばこ以外にも、大気汚染ディーゼル、職業性の発がん物質(アスベスト、鉛、クロムなど)もありますが、大部分は不明です。従って、禁煙だけで肺がんから身をまもることは困難で、症状のないうちに検診で肺がんを早期に発見すること(二次予防)が次に重要になります。しかし、検診によって肺がんの死亡のリスクが減少する度合いは良くて半分程度であり、これにも限界があります。最近は低線量CTが検診に導入されるようになり、更なる肺がん死亡の減少に役立つかが検討されています。
肺の構造と機能
肺は、胸郭内にあり、左右一対からなっています。右の肺は三つの葉(よう)から、左の肺は二つの葉からなっています。気管は枝分かれを繰り返し、だいたい24回の枝分かれの後に肺胞という袋状の部分に達しここで酸素を取り込み、二酸化炭素を排出する働きをしています。
肺がんとは
肺がんは気管支や肺胞から発生する悪性腫瘍の総称です。タバコや化学物質が肺がんの原因になるとされています。腫瘍は肺の局所で腫瘤を作りさらには隣接する臓器へ浸潤を起こし様々な症状を引き起こします。あるいはリンパ節や、遠くの臓器に転移を起こし、最終的には死におとしいれてしまいます。
肺がんは小細胞がんと非小細胞がんに大別され、さらに非小細胞肺がんは腺がん、扁平上皮がん、大細胞がんに分けられています。小細胞がんは、早期より転移傾向が強く、悪性度が一段と高いがんですが、化学療法や放射線に対する感受性が高く、治療の中心は化学療法と考えられています。一方、残り80~90%をしめる非小細胞肺がんは化学療法や放射線に対する感受性が低く、治癒を目指すには比較的早期に発見し、手術によって病巣を取り除くことが一番と考えられています。また、肺がんの発生する場所によって、末梢型と中枢型に分類することもあります。
肺がんの症状
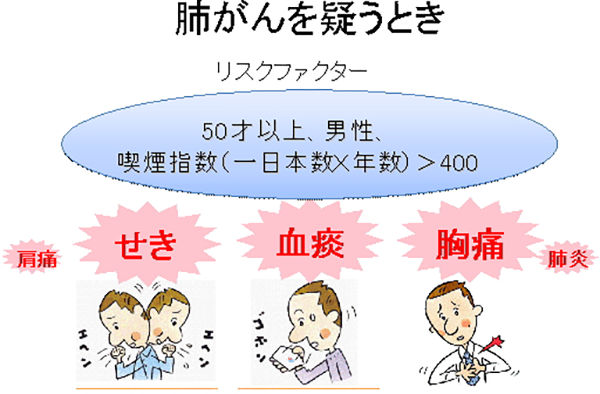
肺がんの症状に特異的なものはありませんが、ある程度進行した症例では、血痰、胸痛、せきなどがみられます。特に喫煙者(喫煙指数(一日本数×年数)が400以上の方は高危険群とされていますので、そのような方では特に、前記のような症状が続くときには専門医の診察を受けることをお勧めします。また、場合により非常に特徴的な症状を出すこともあります。パンコースト型肺がんの場合は、肺の一番上に(肺尖部)にがんができ、腕への神経などを侵すために、頑固な腕の疼痛(とくに上腕内側)、肩痛、瞳孔の縮小、顔面発汗の停止等が見られることがあり、整形外科などを受診して発見が遅れることがあります。また、がん細胞が種々のホルモンを分泌して、ホルモン過剰産成による症状をきたすこともあります。しかし、症状で発見されるがんは一般に進んでいることが多く、できれば無症状の内に検診等で発見して治療したいものです。
肺がんの診断
症状や検診で肺がんの疑いがもたれると、いろいろな検査が行われます。
1)肺がんであるかどうか
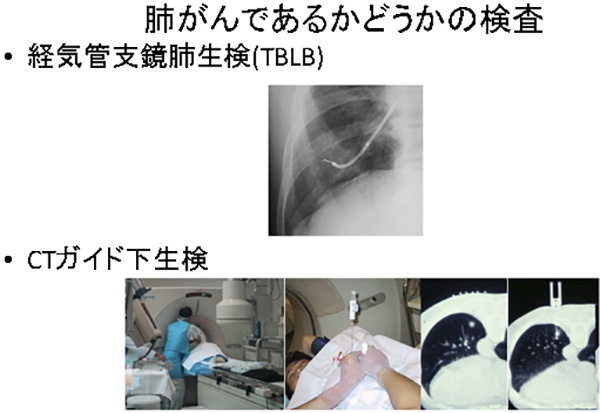
がん細胞の存在を証明する必要がありますが、実際はしばしば困難なことも少なくありません。(超音波)気管支鏡生検(EBUS)、CTガイド下生検、食道・胃からの超音波内視鏡(EUS)生検などがあります。肺内の病変に対して、一般的には気管支鏡検査を行い、組織の一部を採取し病理検査で調べます。CTガイド下肺生検とは、CTを撮影しながらその画像を参考に、直接体外から肺内の病変に向けて検査針を刺し、確実に組織を採取する方法です。
2)肺がんがどのくらい進行しているか(病期診断)
画像検査:胸部X線写真、CT(コンピュータ断層写真)→胸、腹、MRI(核磁気共鳴)→脳、シンチグラム→骨、PET検査などで診断します。胸部のリンパ節の他に、脳、他の部の肺、肝、副腎、骨などへの転移の有無を調べることが重要です。
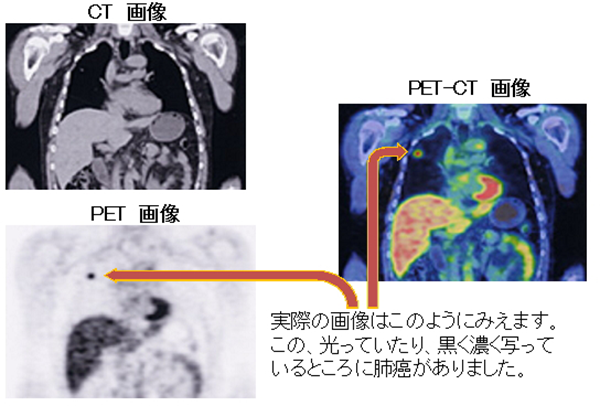
最近導入されたPET検査は「陽電子放射断層撮影」という意味で、ポジトロンCT等ともいわれます。がん細胞は正常な細胞に比べて3~8倍のブドウ糖を取り込みます。PET検査はその性質を利用した検査で、ブドウ糖によく似た構造のFDG(フルオロデオキシグルコース)という薬剤を注射した後、それをPET装置で撮影しFDGの集まり方を画像化して診断するものです。FDGは脳、心臓、腎・尿管・膀胱などの正常臓器に生理的に集積するため、これらの臓器の病変の評価は困難な場合があります。また、活動性の炎症や良性腫瘍にも集積する場合があり、(結核やサルコイドーシスなど)病変の良悪性の判断が困難な場合もあります。また一般には1cm以下の病変については集積の程度によっては検出困難です。病気の広がり(転移部位)がわかり治療方針の決定に役立っています。
3) 1)2)で計画される治療に耐えるだけの体力があるか
がんの治療では手術にしろ、抗がん剤の治療にしろ、いずれにしても患者さんへの負担をゼロにすることはできません。そこで、肺がんの種類や進行度によって計画された治療に、その患者さんが耐えられるかどうかを総合的に評価する必要があります。これには血液検査、心電図検査、肺機能検査などで全身の機能を調べます。
肺がんの病期(ステージ)
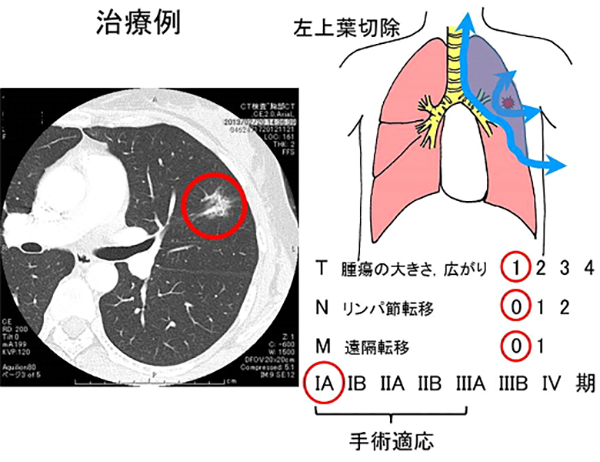
治療方針の決定のためにはどのくらい病気が広がっているか(ステージ)を決定することが非常に重要になってきます。具体的には、肺の原発腫瘍の広がり(T)、リンパ節転移(N)、遠隔転移(M)のそれぞれについて点数をつけ、その組み合わせでI期からIV期のステージが決められています。一般的に、I期からIIIA期の一部までが手術の対象と考えられています。
具体的には、
- T1:腫瘍の充実成分径≦3cm
- T2:充実成分径>3cmでかつ≦5cm
- または充実成分径≦3cmでも以下のいずれかであるもの
- 主気管支に及ぶが気管分岐部には及ばない
- 臓側胸膜に浸潤
- 肺門まで連続する無気肺か閉塞性肺炎がある
- または充実成分径≦3cmでも以下のいずれかであるもの
- T3:充実成分径>5cmでかつ≦7cm
- または充実成分径≦5cmでも以下のいずれかであるもの
- 臓側胸膜、胸壁、横隔神経、心膜のいずれかに直接浸潤
- 同一葉内の不連続な副腫瘍結節
- または充実成分径≦5cmでも以下のいずれかであるもの
- T4:充実成分径>7cm
- または大きさを問わず横隔膜、縦隔、心臓、大血管、気管、反回神経、食道、椎体、気管分岐部への浸潤、あるいは同側の異なった肺葉内の副腫瘍結節
- N0:リンパ節転移無し
- N1:肺門部リンパ節転移
- N2:同側縦隔リンパ節転移
- N3:反対側縦隔、鎖骨上リンパ節転移
- M0:遠隔転移なし
- M1:あり
肺がんの治療法
肺がんの治療方針は、肺がんの病期、患者さんの体力(生理学的機能)、肺がんの種類(組織型)、および肺がんの遺伝子異常のタイプによって決められています。
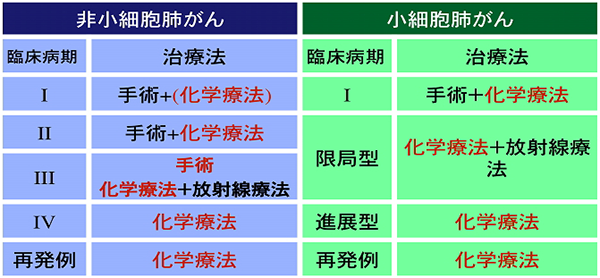
非小細胞肺がんの治療方針
非小細胞肺がんはIA期からIIIA期の一部まで(局所に限局している病期)が手術の対象となります。IA期の限局したがんで手術の実施が難しい場合では局所にピンポイントに放射線治療を行う体幹部定位放射線治療も有効です。進行したIIIA期やIIIB期(局所で進展している時期)では、放射線と化学療法を組みあわせて同時に治療を行うことが標準治療です。放射線は60グレイ程度、一日2グレイで30回(6週)、化学療法はプラチナ併用化学療法を、1~2クール行い治療後に免疫チェックポイント阻害剤の補助療法を併用します。放射線治療では、画像上の病変部を中心に放射線治療の計画をたてます。肺にあたる範囲により副作用のリスクが大きく変わってきますので最近では強度変調放射線治療(IMRT)と呼ばれる高精度技術を用いて肺への放射線の影響を減らす治療法が多くなってきています。IV期(遠隔転移がある病期)では、局所療法である外科手術や根治的放射線治療は行わず、化学療法を主体とする治療を行います。条件が合う患者では転移病巣に定位放射線治療を行うことがあります。同じ病期でも、がんの進行具合、年齢、全身状態、心肺機能、合併症などにより、治療法の選択は変わってきます。
肺がんの外科治療
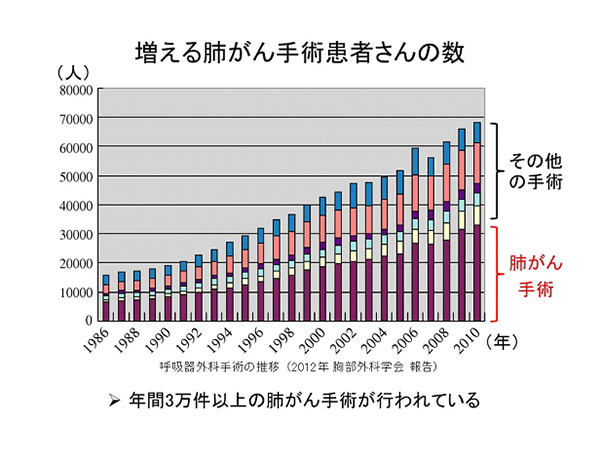
肺がん患者さんの数は年々増加しており、手術を受けられる患者さんの数も経年的に増加しています。早期肺がんから進行肺がんまでの全肺がん患者さんのおよそ3割の方に手術治療が行われています。
肺癌の治療は、画像から判断される進行度(臨床病期)に基づいて行われており、病態の理解が大切です。治療方法の選択として手術と放射線療法は局所の治療、抗がん剤は全身治療になります。IA期からIIB期までは手術が第一選択と判断されることが多く、縦隔リンパ節転移を認めるIIIA期では、手術適応は一部です。IIIB期以降では手術の適応は少なくなり他の治療法を選択することが多くなります。

手術をするとどのくらい治るのか?このことは通常5年生存率(治療日を基準にして時間経過とともにどのくらいの患者さんが生存しているか)という数値で表されます。統計ですから患者さんごとに様々な経過をたどりうるということに留意する必要があります。
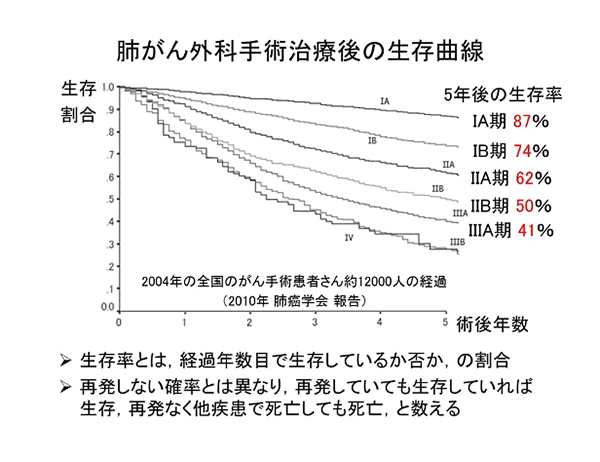
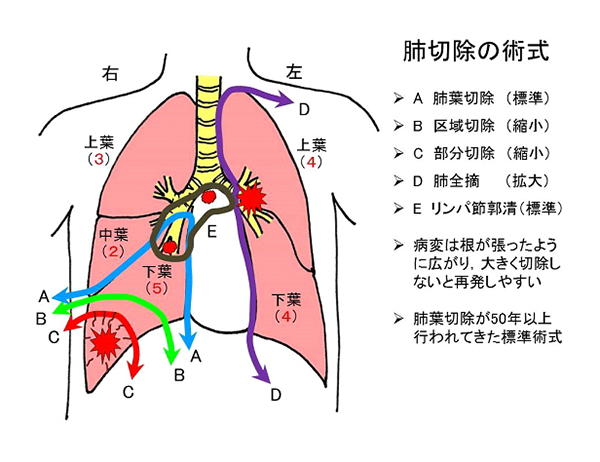
肺癌の標準術式は病変のできた肺を袋(葉)の単位で切除する肺葉切除です。病変は小さくても「根」が張ったように広がっており、病変の見かけの大きさよりも大きく肺を切除する必要があります。区域切除は肺葉より小さな解剖学的単位で肺を切除する方法、部分切除はそれよりさらに小さく切除する方法で、呼吸機能等身体的に肺葉切除が困難な場合に行われます。また区域・部分切除は術前のCTで病変の「根」が大きくないと判断される病変にも適応されるようになってきました。さらに転移が生じうるリンパ節を切除し転移の有無を調べるリンパ節郭清が組み合わされて標準術式となります。
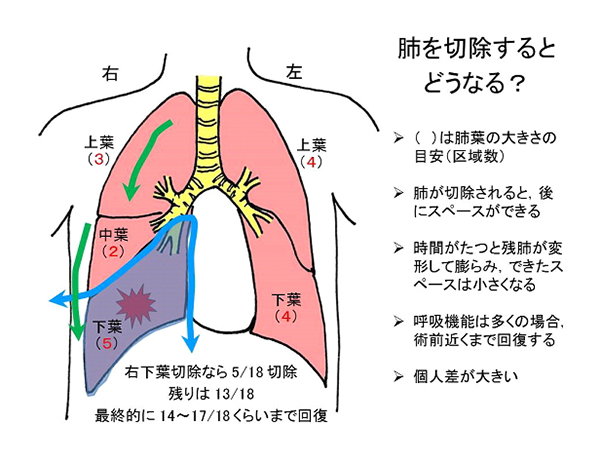
肺が切除された部位は空洞のようになりますが残存肺が変形・拡張して膨張するという変化を示します。数ヶ月の単位で変化し、個人差が大きい部分です。

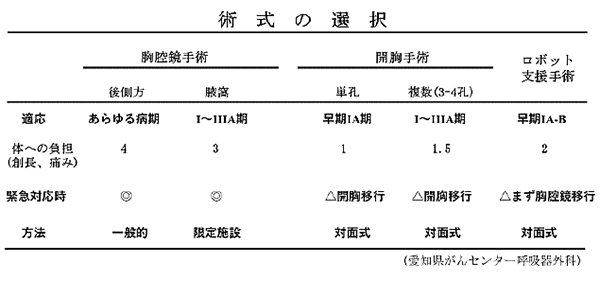
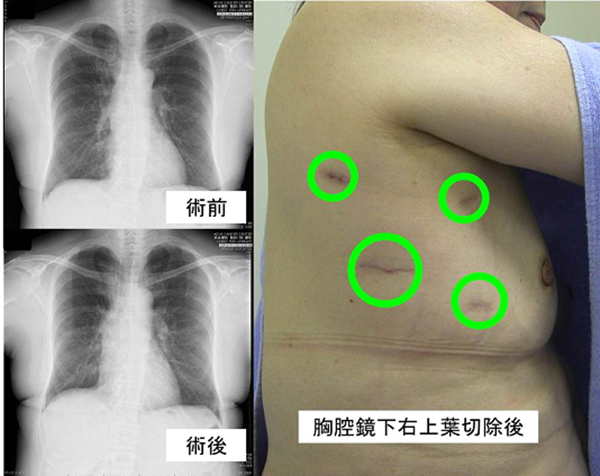
手術の方法には大きく分けて開胸手術と胸腔鏡手術があります。胸腔鏡手術は近年進歩してきた方法で当院では主に早期の肺癌に適応としています。施設毎に適応や方法が異なります。
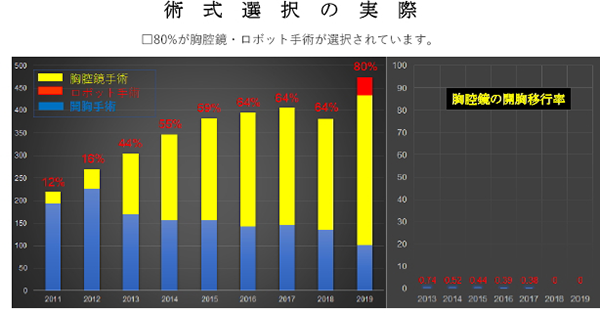
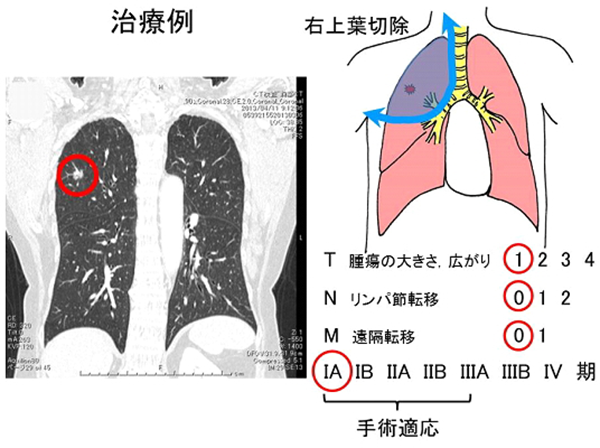
治療例。右上葉肺腺癌IA期。胸腔鏡下右肺上葉切除+リンパ節郭清。4年無再発。
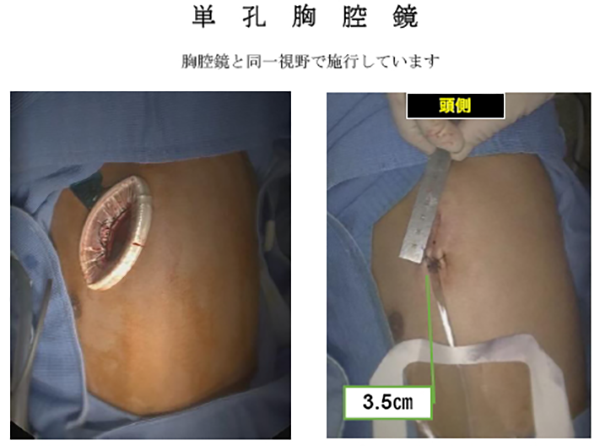
治療例。左下葉肺腺癌IA1期。単孔式左S9+S10区域切除。術後2日目に退院。
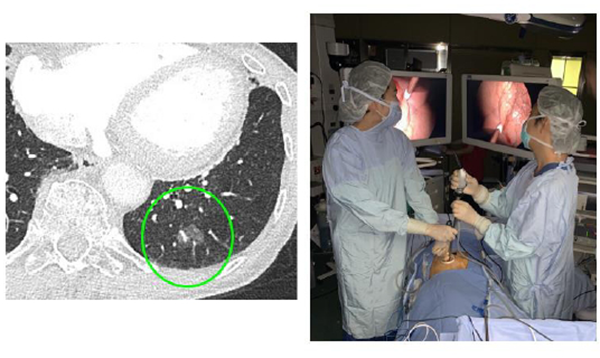
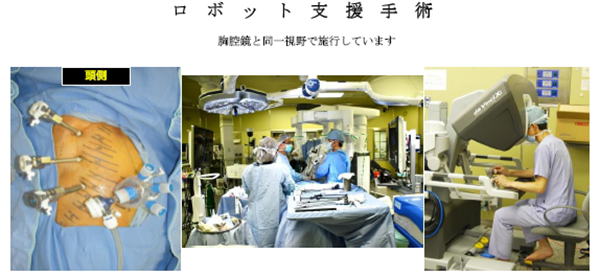
治療例。左上葉肺腺癌IA2期。ロボット支援右上葉切除+縦隔リンパ節郭清を施行。術後2日目に退院。
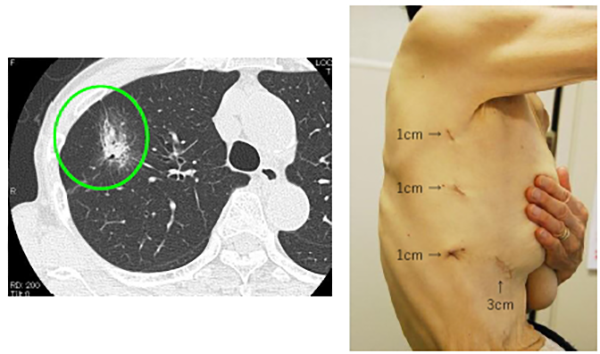
治療例。左上葉肺腺癌IA期。腋窩小開胸左上葉部分切除による診断後に左上葉切除+リンパ節郭清。4年無再発。
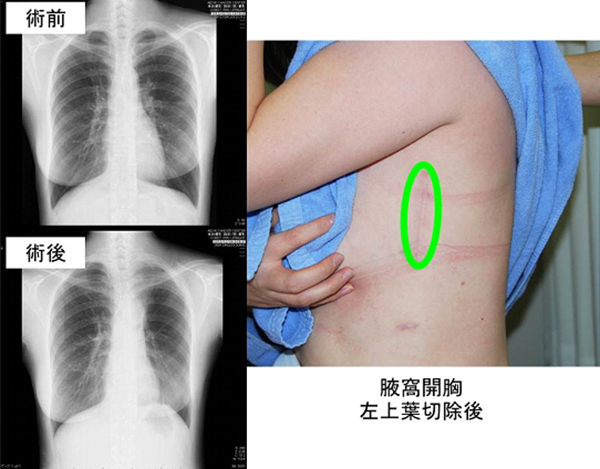
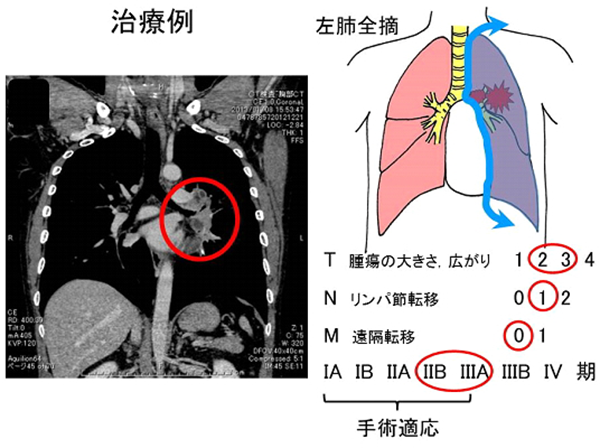
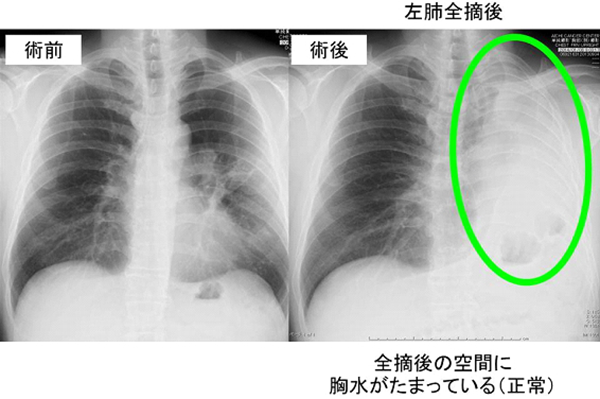
治療例。左上葉肺門部扁平上皮癌IIB期。左肺全摘+リンパ節郭清。4年無再発。
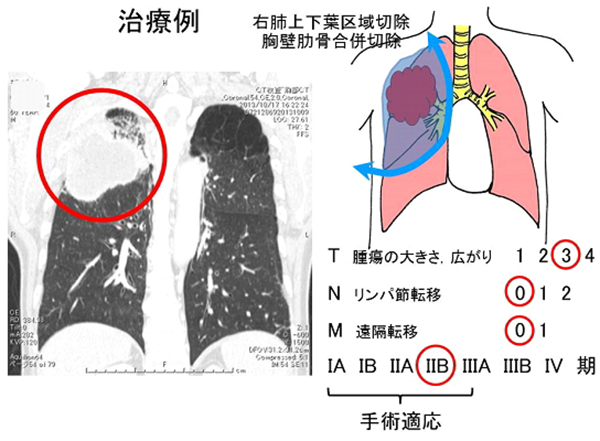
治療例。右上葉扁平上皮癌+胸壁浸潤+低肺機能IIB期。肺を温存し肺上下葉区域切除+肋骨胸壁合併切除+リンパ節郭清。4年無再発。
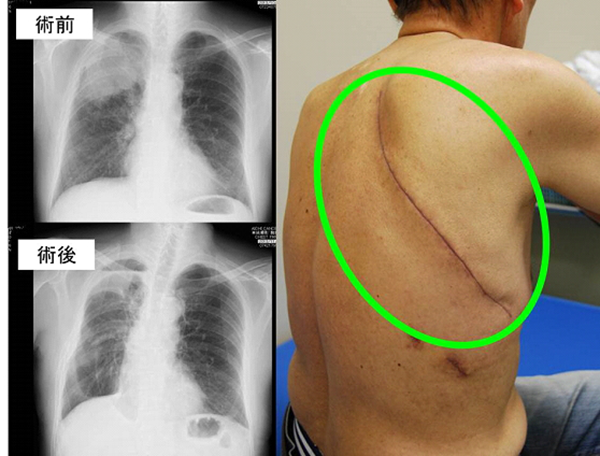
肺癌の手術では病変よりも大きく肺を切除するため、呼吸機能の低下が起こり得ますし、身体に負担となります。患者さんの持つ因子(喫煙、心肺機能、糖尿病等々)も大きく関連します。肺切除手術で生じうる周術期の死亡率はおよそ0.3~0.4%(2010年肺癌合同登録委員会報告の全国データ)とされます。主な原因は、呼吸不全、肺炎、出血、感染、余病の発生(心筋梗塞、脳卒中、肺梗塞)などです。手術に伴うリスクには以下のようなものがあります。

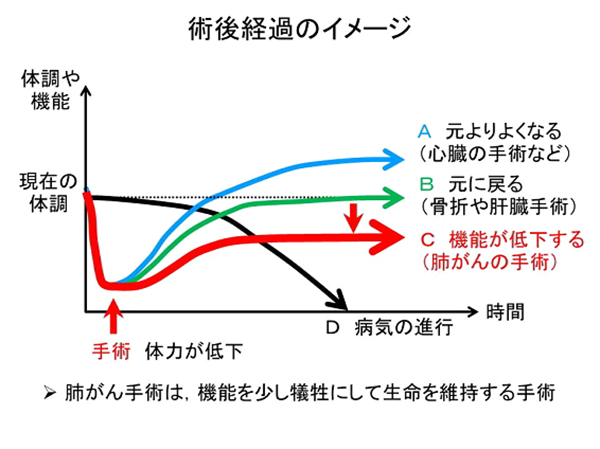
通常、手術日からおよそ1週間から10日で退院となります。退院可能とは、全快した状態ではなく自宅療養が可能と判断された状態です。その後2週から1ヶ月~3ヶ月毎に通院していただき術後の経過をみます。術後およそ2ヶ月間は患側上肢に運動制限が感じられる場合が多く、この期間は車の運転や過剰な力がかかる動作は控えていただく必要があります。およそ3ヶ月~半年を過ぎる頃からもとに近い生活ができます。

手術には、術後に、術前より調子がよくなったり、すっかり元に戻る、というタイプの手術もありますが、肺癌に対する肺切除では大きく肺を切除するために、経過が順調でも少し息が切れる、神経痛が残るといった術後のほうが調子が悪く感じてしまうような現象が生じ得ます。これらの症状は月単位の時間とともに軽快していきますが、術後の体調の変化はこのような経過をたどることに留意する必要があります。
我々は最善最良の手術治療が進みますよう最大限の努力をしてまいります。呼吸器外科もご参照ください。
(肺がんの外科治療 文責 呼吸器外科部 坂倉範昭)
肺がんの放射線治療
がんの放射線治療にはライナックなどの大型治療装置で体の外から放射線を照射する方法(外部照射法)が中心です。肺がんの放射線治療は高エネルギーX線をもちいた三次元治療計画で週5回6週間程度の分割照射が主流です。また三次元治療計画がより進歩した強度変調放射線治療により肺や心臓への副作用をへらしより進んだ範囲まで安全に治療が行える様になってきました。
また、手術が困難なIA期肺癌にたいしては体幹部定位放射線治療が標準治療として普及しています。この方法は一回大線量の放射線をピンポイントに1週間程度で投与します。治療効果も高く副作用も少ない有望な治療法です。臨床試験による結果で手術との成績にも大きな差はなく、副作用も少ないレベルと報告されました。日本中の多くの施設で多数の治療実績があり手術が困難な患者さんに対しては標準治療として肺がん診療ガイドラインにも紹介されています。
粒子線治療(陽性線や重粒子線)も先進医療として一部の専門施設で行われています。この方法は通常の高エネルギーX線による治療では困難な大きな病気に対してより有効になる場合があると考えられています。
IIIA/IIIB期の局所進行非小細胞肺がんに対してプラチナ製剤を主とした化学療法の同時併用が標準治療となっています。また現在は化学放射線療法後に免疫医チェックポイント阻害剤のデュルバルマブを補助療法で追加で、再発をへらし成績が改善することがわかりましたので、標準治療と考えられています。放射線治療は非小細胞肺がんでは一日一回、週5回、一回2グレイ、合計で60グレイが標準治療です。小細胞肺がんでは一回1.5グレイを一日二回の加速過分割照射で45グレイ照射することが一般的です。化学療法後に放射線を行う場合は非小細胞肺癌と同様のスケジュールを行う事もあります。副作用には食道炎、肺臓炎、皮膚炎などがあります。現在は強度変調放射線治療という高精度な治療技術を用いて肺毒性を減らすことができるため従来放射線治療の実施困難であった患者さんにも安全に治療を行う事ができるようになりました。
また、肺がん脳転移に対しては大きさが3cm以下、数が5個程度であれば、ガンマナイフ治療や定位放射線治療(ピンポイント照射)が有効です。脳転移の制御効果がたかく、正常の脳組織への余分なダメージを減らすことができます。ガンマナイフの治療では一般に頭蓋骨へ金属ピン固定が必要で負担になりますが、リニアックによる定位放射線治療は固定マスクを作成し治療毎CTを撮影して正確に位置合わせをしますので患者さんの負担がすくなくすみます。ガンマナイフは1回の治療が原則ですがリニアックの定位放射線治療では分割回数を1-5回に調整することで大きめの腫瘍や正常臓器へのリスクを下げる工夫ができる利点が有ります。多発転移の場合には全脳照射を行うことが一般的です。
脳転移以外にも3個までの肺転移・肝転移、5cmまでの脊椎転移、5個までの限局転移にたいして体幹部定位照射(ピンポイント治療)が保険適応になりました。この方法は放射線の効果が高いことから、条件のあう患者さんでは延命効果も期待できることが報告されており、今後治療の機会が増えると予想されます。
肺がんの症状(疼痛、気道が狭くなる状態、神経障害)の緩和目的・予防目的で骨などの症状の原因となる病気の部分へ緩和照射を行うことがあります。治療スケジュールは1-10回程度を1日から2週間程度で行います。短期間で7割程度の患者さんに症状を緩和することができ副作用も少ない安全な方法と考えられています。
肺がんの内科治療

1. 化学療法
プラチナ(白金)製剤といわれるシスプラチン、カルボプラチンのどちらかに、90年代に登場した新しい抗がん剤(新規抗がん剤)のうちいずれか1種類を選んで併用し、3-4週ごとに4回治療すること(プラチナ2剤療法)が標準的です。大規模な検討の結果、どの組み合わせで治療を行っても得られる効果は大体同じくらいと考えられており、中間生存期間は約1年、1年生存率は50%から60%です。高齢者や、PS不良患者には、新規抗がん剤の中から1種類だけ選んで単独で投与する治療法もよく行われます。
ペメトレキセドには組織型による効果の差があり、腺がんを中心とする非扁平上皮がんにおいて、シスプラチン+ゲムシタビン群に比べてシスプラチン+ペメトレキセド群は有意に生存期間を延長することが認められました。その結果ペメトレキセドは非扁平上皮がんに使用されています。
抗がん剤の副作用は薬の種類によって異なりますが、アレルギー反応、消化器症状(嘔気・嘔吐)、血液毒性(白血球減少・貧血・血小板減少)、肝障害、肺障害、腎障害・心毒性、末梢神経障害(しびれ)、脱毛、便秘・下痢などがあります。
プラチナ2剤治療を行った後、二回目に行う治療をセカンドライン治療といいますが、その治療はドセタキセルの単剤使用が標準でした。最近では、初回治療として免疫治療+化学療法の併用が行われています。
2. 分子標的治療(精密医療)
肺がんでは、EGFR、ALK、K-RAS、MET、ROS1、BRAF、RET、HER2、NTRK1などの遺伝子異常がみつかり、それぞれの遺伝子異常に対する個別化治療薬(分子標的薬)の開発が進み、精密医療を行うことにより大きな効果が認められるようになってきました。

その他、血管内皮成長因子(VEGF)に対する抗体であるベバシズマブは、非扁平上皮がんにおいてプラチナベースの標準化学療法に上乗せ効果があることが明らかとされ(カルボプラチン+パクリタキセル 10.3月に対してベバシズマブを加えると12.3月)、血管新生阻害薬の適応に合致した患者さんの標準治療となっています。喀血が有害事象として報告されており注意は必要です。最近ラムシルマブも使えるようになりました。
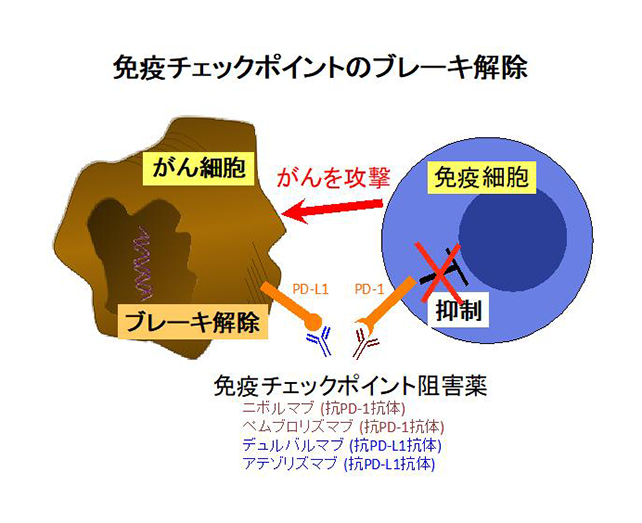
3. 免疫療法
がん細胞への直接攻撃ではなく、自分自身の免疫ががん細胞に有効に働くようにする新規免疫療法の開発も急速に進み、劇的な効果も見られています。ヒトには免疫反応の調節メカニズムとして、自己に対する過剰な免疫反応や正常組織への障害を抑えるための機構、免疫チェックポイント機構が働いています。がんはこの機構を利用してがんに対する攻撃にブレーキをかけています。このブレーキを解除するのが免疫チェックポイント阻害薬で、最初に開発されたニボルマブは皮膚がん、非小細胞肺がんに続き、腎細胞がん、ホジキンリンパ腫などへの治療も認可されました。免疫療法で高い効果が得られる人を治療前に予測する方法についての検討が現在精力的に行われています。ニボルマブに続き、ペムブロリズマブ、デュルバルマブ、アテゾリズマブといった免疫治療薬も使用され、今後のベストな使用方法について、治療効果の予測や治療必要期間、また他の治療法との併用等について詳細な検討が進行しています。

小細胞肺がんの治療
一方、小細胞肺がんは非小細胞肺がんより放射線、化学療法の感受性が高いこと、発見時にすでに全身へ転移していることが多いことなどから、非手術療法を選択されることが多くなります。
小細胞がんでは治療計画をたてるために、上記のTNM病期よりも、病変が放射線のかけられる範囲(片肺から鎖骨上窩)にとどまっている場合(限局型、LD)かそれ以上に広がっているか(進展型、ED)の分類を用いることが多くなっています。
LDでは化学療法と胸部放射線療法の同時併用を行います。現在では、シスプラチンとエトポシドの2剤併用化学療法と胸部放射線治療を同時に行う方法が最も優れた治療法とされています。限局型の治療成績は1981年では中間生存期間は14ヶ月、3年生存率15-20%と報告されていましたが、現在ではそれぞれ20-27ヶ月、30-40%と約2倍に向上しています。胸部放射線療法は一日二回照射法(加速分割照射)の方が1日一回よりも優れているとされていますが、放射線食道炎も高頻度となります。完全寛解に到った症例では予防的全脳照射(PCI)を行います。脳転移の相対リスクが0.46と減少するのみでなく、3年生存率が15.3から20.7%程度向上し生存期間の延長が得られるとされています。
EDの標準的な治療法として、シスプラチンにエトポシドまたはイリノテカンを組み合わせる併用化学療法があります。進展型の治療成績は1981年では生存期間中央値7ヶ月でしたが、日本臨床腫瘍研究グループで行われた臨床試験においてシスプラチンとイリノテカン併用化学療法は生存期間中央値12.8ヶ月と2倍近い治療成績を示し、世界から大きな注目を集めました。また、2007年の米国臨床腫瘍学会において、進展型においても奏効例にはPCIを併用することで予後が改善することが示されています(一年生存率13.3%対27.1%)。最近では、化学療法に免疫治療の併用療法が行われています。
臨床試験について
当院では新治療法(標準治療)確立のための多数の臨床試験を行っています。これは、より効果があり、より副作用の少ない明日の標準的治療を確立するための非常に重要なプロセスです。一方で、未知の部分のある新しい治療を試すという側面もあることから、患者さんの不利益を回避するために、「臨床試験」では厳密な治療計画書が作成され、当院の倫理審査委員会や効果安全性評価委員会など第三者のチェックを受けており、また、患者さんによく説明した上での同意(インフォームド・コンセント)を得てから開始します。新薬の開発を目的として行う臨床試験を治験と呼び、当院では多数の新規分子標的薬や免疫治療薬の治験を行っています。
説明と同意について
医師にとって、患者さんに病気と治療法について、よく理解していただけるよう工夫して説明しなければなりませんが、詳細かつ正確な説明は極めて難しいことです。一方、患者さんも、自らの病気と治療法について、具体的な知識をもつ必要があります。このようにして皆でよく相談した上で最善と思われる治療を選択していきたいと考えています。私たちは、患者さんが肺がんの診断・治療を受ける前に、病気に関する正確な情報を得た上で、検査や治療に対してご自身で決定を行うことが大切と考えています。
悪性胸膜中皮腫
胸膜中皮腫
アスベスト曝露との関連で中皮腫発症の増加が社会問題になっています。ギリシャ語の永久不滅を意味する語に由来するアスベストは、古代エジプトではミイラを包む布にアスベストで織った布が使われ、古代ギリシャでは耐火用に使用され古くから重宝されていました。1900年代になるとアスベストによる健康被害を指摘する報告がみられ、1959年ヨハネスブルグで開かれた国際じん肺会議では、アスベスト曝露と胸膜中皮腫の関連が報告されています。残念ながら日本での規制は遅れ、対策の遅れから今後の急増が懸念され社会問題になっています。
アスベスト曝露によって生じる疾患としては、肺には石綿肺、肺がん、胸膜には胸膜中皮腫のほか、良性疾患として良性石綿胸水、びまん性胸膜肥厚、胸膜肥厚斑(胸膜プラーク)、円形無気肺があります。中皮腫は胸膜以外に、腹膜、心膜、精巣鞘膜に発生し、石綿曝露の客観的医学所見としては、壁側胸膜に、通常接触後10年以上を経て胸部X線写真で認められるようになり、20年以上経過すると石灰化も伴う局所的な肥厚である胸膜プラークや、アスベスト繊維がフェリチンで被覆された石綿繊維が喀痰、気管支肺胞洗浄液や肺組織から検出される事により確定されます。悪性疾患である胸膜中皮腫の平均潜伏期間が40年以上である事を考えますと、戦後工業製品を中心にアスベストを汎用してきた日本においてアスベストによる胸膜中皮腫が急増する事は確実とされています。
胸膜中皮腫の診断には難渋するケースも多いのですが、当院では遺伝子病理診断部との密接な連携のもと正確な診断を行っています。胸膜中皮腫の治療は、外科的切除、化学療法、放射線療法、またこれらの治療法を組み合わせて行っていますが、化学療法では新規葉酸拮抗薬ペメトレキセドの悪性胸膜中皮腫に対する良好な抗腫瘍活性が示され、化学療法のkey drugとして用いています。2次治療では免疫治療が行われています。
以下のサイトでも肺がんを解説していますので、ご参考になさってください。

