大腸がん
はじめに
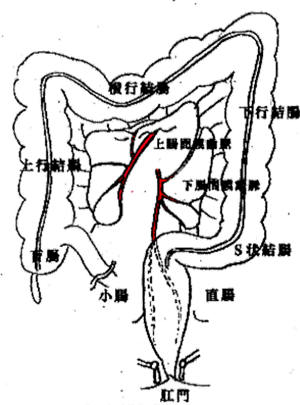
大腸は消化吸収が行われた食物の最終処理をする消化管で主に水分を吸収して排泄に都合のよい状況をつくり出します。大腸は約1.5mの長さがあり、口側から盲腸、結腸、直腸・肛門管(肛門縁から約15cmが直腸・肛門管)の順で構成されます(図1)。
日本の大腸がん罹患率は1990年半ばまで増加し、全国がん登録(国立がんセンターがん対策情報センター)によれば、2001年に10万の大台に乗り、いったん減少したものの、その後再び増加に転じ、2017年には153,193名がかかり、男性は前立腺がん・胃がんに次いで第3位、女性では乳がんに次いで第2位の座を占めています。また年齢別の罹患率では50歳代付近から急速に増加し、高齢になるほど高くなります。大腸がん死亡数は男女ともに著しく増加しており、1958年には4822人であった大腸がん死亡数は2018年には5万人を超えており約10倍以上になっています。死亡数は男性が女性を上回っていますが、がんの死因では大腸がんは、男性は肺がん・胃がんに次いで第3位であるのに対して女性は2003年に胃がんを抜いてからは第1位となっています。
大腸がんの発生には遺伝的因子より環境的因子の比重が大きいと考えられています。食生活の欧米化つまり動物性脂肪や蛋白質の摂取量増加が日本における大腸がんの増加の原因ではないかと言われています。現時点で証拠が明らかなリスク要因に、飲酒、肥満、加工肉・赤肉摂取が、予防要因に運動習慣が挙げられます。一方、遺伝的素因もその発症には関与しており大腸がんにかかりやすい高危険群として家族の中に大腸がんにかかった人がいることがあげられています。その他にも1)過去に大腸ポリープができたことがある。2)10年以上潰瘍性大腸炎にかかっている。3)痔瘻が何年も続いている。4)過去に骨盤腔に放射線をあてたことがある。などが高危険群としてあげられています。特にこのような方は定期的な大腸がん検診が必要とされています。
大腸がんの症状
早期のがんでは症状はまずありません。便に血が混じっている(血便)場合はがんの注意信号です。がんの表面が潰瘍で出血しやすくなっているためです。肛門に近い部位にがんができた場合排便の際に肛門から出血する場合もあります。この症状は痔核と思われて放置されることがあります。痔核と診断するためには大腸がんでないことを確認する必要があります。右側の結腸がんでは肉眼的な血便に気づかず慢性的な出血による貧血によって発見される場合もあります。また、最近排便回数が増加してきた、腹痛がある、残便感が常にある、便柱が細くなったなど排便状況が変化したと気づいた場合は大腸がんによる症状であることもあり一度大腸検査をしてみるべきでしょう。また、嘔吐などの腸閉塞症状、腹部や頚部の腫瘤が初徴候のこともあります。
大腸がんの診断
A)便の免疫学的潜血反応
ひとの赤血球に含まれるヘモグロビン(血色素)を検索する方法で従来の鉄分を検索する方法に比べて偽陽性(血液が混じっていなくても陽性になること)の比率が減少しました。それでも、二日間続けて検査をした場合、陽性者のうち、大腸癌が発見される確率は、約3%です。確定診断を得るためには大腸内視鏡検査が必要です。本検査法は多人数集団から精査が必要な人をふるい分ける経済的にも身体的にも負担の少ない方法です。50歳以上の方に勧められています。一方、進行大腸がんがあった場合でも、80%程度の陽性率です。つまり、20%は見逃されてしまうので、潜血反応陰性が続いていても3-5年毎に大腸内視鏡検査をお勧めします。
B)注腸造影検査
食事制限と下剤の処置により大腸をきれいにして、肛門からバリウムと空気を大腸全体に送り込んでレントゲン写真をとります。比較的負担の少ない方法ですが大腸のきれいになり具合やバリウムや空気の送り込み具合によって診断の精度が変わってくることがあります。
C)大腸内視鏡検査
下剤、浣腸の処置により大腸をきれいにしてから肛門から内視鏡を挿入して大腸内腔を観察します。たわんだ大腸では挿入に手間取ることもありますが比較的小さな病変も見逃さずに診断することができ、精度の高い診断方法です。さらに大腸腫瘍の診断では、拡大内視鏡を用いて表面の腺管構造(pit pattern分類)を観察することで、腫瘍の質的診断や深達度診断が可能となります。最近では、NBI(narrow band imaging;狭帯光観察)に代表されるIEE(image-enhanced endoscopy;画像強調観察)の登場で、より簡便に腫瘍の血管や表面構造が協調され、腫瘍の質的診断や深達度診断が可能となっています。
D)CTコロノグラフィー
CTコロノグラフィー(バーチャルコロノグラフィーともいいます)は、肛門から大腸・直腸内へ空気を注入したうえでCT撮影を行い、画像処理を行って実際の内視鏡でのぞいているように画像を再構成する方法です。腸の癒着などによって腸の曲がりが著しく大腸内視鏡の挿入が困難な方やご高齢の方などリスクを伴うと判断された方にはお勧めの方法です。ただし、大腸内視鏡検査と同様に腸管をきれいにする前処置は必要です。また、病変が見つかった場合には、やはり大腸内視鏡検査が必要となります。
E)大腸カプセル内視鏡検査
大腸カプセル内視鏡検査は小型カメラを内蔵したカプセル型の内視鏡を服用しその後下剤で押し流すことで、腸管内部を進みながら小型カメラで大腸内の写真を撮影していきます。2014年1月から本邦で保険適用となりました。検査後、専用コンピューターで画像を解析することで、大腸疾患の診断を行います。麻酔も必要なく、放射線被ばくの心配もありませんがCTコロノグラフィーと同様に病変が見つかった場合には大腸内視鏡検査が必要です。
F)腫瘍マーカー
血液の検査でがんの進行程度、治療効果、再発の有無をチェックする方法です。特にCEAと呼ばれるマーカーが大腸がんには陽性率が高く、進行がんで約半数が陽性を示します。他に、CA19-9、p53抗体があります。しかし、大腸がんの腫瘍マーカーは、進行していないと正常値のことが多く、がんを見逃さないようにするのは不得意です。
G)画像診断:CT(コンピューター断層写真)、MRI(核磁気共鳴画像)、US(超音波診断)
大腸自体のがんの診断には上記の方法に劣りますが、がんの転移や周囲臓器への浸潤具合などを調べることができ、治療にとっては不可欠な検査です。MRIは特に直腸癌など骨盤内臓器への浸潤を調べる際に有用な検査です。
H)PET検査(陽電子放射断層撮影:Positoron Emission Tomography)
がん細胞が正常細胞に比べて多くブドウ糖を取り込む性質を利用して、ブドウ糖に似た物質にアイソトープで目印をつけて(FDG)体内に注射し、全身にわたって集積の有無をみる検査です。上記画像診断でわかりにくい転移、再発の検索に有効な検査です。
大腸がんの進行度(stage、ステージ)
進行度については日本では大腸がん取扱い規約第9版(2018)に従って分類されます(表1)。国際的にはTNM分類が使用されます。進行度を設定することにより、過去のデータをもとにした治癒率の目安が得られます。
進行度は0, I, Ⅱa, Ⅱb, Ⅱc, Ⅲa, Ⅲb, Ⅲc, Ⅳa, Ⅳb, Ⅳc期の順で進行した状況となります。
| 遠隔転移 | M0 | M1 | |||||
|---|---|---|---|---|---|---|---|
| M1a | M1b | M1c | |||||
| リンパ節転移 | |||||||
| 壁深達度 | N0 | N1 | N2a | N2b N3 | Any N | ||
| Tis | 0 | ||||||
| T1a/T1b | Ⅰ | Ⅲa | Ⅲa | Ⅲb | Ⅳa | Ⅳb | Ⅳc |
| T2 | Ⅰ | Ⅲa | Ⅲb | Ⅲb | |||
| T3 | Ⅱa | Ⅲb | Ⅲb | Ⅲc | |||
| T4a | Ⅱb | Ⅲb | Ⅲc | Ⅲc | |||
| T4b | Ⅱc | Ⅲc | Ⅲc | Ⅲc | |||
Tis:がんが粘膜内にとどまり、粘膜下層に及んでいない
T1a:がんが粘膜下層(SM)までにとどまり、浸潤距離が1000μm未満である
T1b:がんが粘膜下層(SM)までにとどまり、浸潤距離が1000μm以上であるが固有筋層(MP)に及んでいない
T2:がんが固有筋層まで浸潤し、これを越えない
T3:がんが固有筋層を越えて浸潤している
T4a:がんが漿膜表面に接しているか、またはこれを破って腹腔に露出しているもの
T4b:がんが直接他臓器に浸潤している
N0:領域リンパ節転移を認めない
N1:腸管傍リンパ節と中間リンパ節の転移が1-3個
N1a:腸管傍リンパ節と中間リンパ節の転移が1個
N1b:腸管傍リンパ節と中間リンパ節の転移が2-3個
N2:腸管傍リンパ節と中間リンパ節の転移が4個以上
N2a:腸管傍リンパ節と中間リンパ節の転移が4-6個
N2b:腸管傍リンパ節と中間リンパ節の転移が7個以上
N3:主リンパ節に転移を認める。下部直腸がんでは主リンパ節あるいは側方リンパ節に転移を認める
M0:遠隔転移を認めない
M1:遠隔転移を認める
M1a:1臓器に遠隔転移を認める
M1b:2臓器以上に遠隔転移を認める
M1c:腹膜転移を認める
大腸がんの治療
治療法には内視鏡的治療、外科治療、化学療法(抗がん剤)、放射線治療があります。外科治療を軸に治療方法が選択されます。治療法についてはエビデンスをもとに、ガイドラインが発表されています。(注:ガイドラインは60-95%のケースに適用されますが、患者の状況によっては医師の判断で適用するかどうか決めるべきものと定義されています。)
日本では患者さんのための大腸癌治療ガイドライン 2019年版(日本大腸癌研究会編、金原出版)があります。また全米を代表とするがんセンターで結成されたガイドライン策定組織 NCCN(National Comprehensive Cancer Network)があり、世界的に広く利用されています。NCCNガイドライン日本語版アーカイブはインターネットで閲覧できます(http://www.tri-kobe.org/nccn/guideline/archive/)。ここでは日本での大腸癌治療ガイドラインに沿った当院での治療方針を述べます。
A)内視鏡治療
内視鏡治療は主に早期がんに対して行われています。早期がんの定義はがんの深達度(深さ)が粘膜固有層、粘膜下層にとどまるものとされています。前述の進行度(stage)では0期全て、I期の一部(固有筋層浸潤がんを除く)となります。早期がんの治療法もそのがんの深達度によりさらに細分類されます。
a)粘膜内がん(mがん)
内視鏡治療の対象となるのは、Stage0の『粘膜内(mucosal:M)がん』とStageⅠのうち『粘膜下層(submucosal:SM)への軽度浸潤がん』です。上述の検査を総合し壁深達度がMがん・SM軽度浸潤がんと考えられる病変に対しては、内視鏡的摘除を施行します。早期がんは切除後の正確な病理学的診断が必要のため一括切除が大原則とされています。
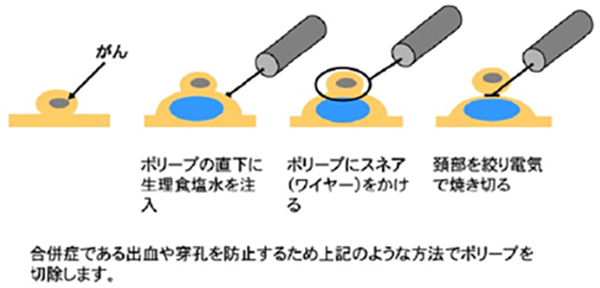
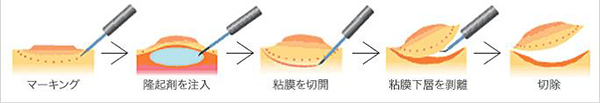
内視鏡的粘膜切除術(endoscopic mucosal resection:EMR)(図2)の開発・普及により大きな広基性隆起性病変や平坦陥凹性病変の内視鏡的な治療が容易になりましたがEMRにより一括切除が可能な大きさは2cmが上限とされてきました。近年、内視鏡的粘膜下層剥離術(endoscopic submucosal dissection:ESD)の保険収載の普及により、大きさの制限はなくなりました。(表2)

ESDは、粘膜下層へ生理食塩水やヒアルロン酸などの薬剤を注入後、専用のメスで病変周囲の粘膜切開し粘膜下層を剥離して病変を摘除する方法です(図3)。ESDにより大きな病変でも一括で切除することが可能となり、正確な病理学的診断が可能になりました。
b)粘膜下層浸潤がん(smがん)
早期がんでも一定以上の深さ(専門的には粘膜筋板を越えて粘膜下層に浸潤しているといいます)に達しているものを粘膜下層浸潤がん(smがん)としています。smがんは全体で約10%のリンパ節転移の可能性があり、リンパ節郭清を伴った腸管切除の適応を検討する必要があります。大腸癌治療ガイドライン医師用(2019)では、内視鏡的に病変を切除し、病理組織学的検査の結果で、sm浸潤度1000μm(1mm)以上、脈管侵襲陽性、組織型(低分化腺癌、粘液癌、印環細胞癌)、簇出のいずれかの因子があった場合に追加で手術を考慮するとされています。つまりsmがんであってもsm浸潤度1000μm(1mm)未満で他のリスク因子がなければ、慎重な経過観察のもと追加切除を行わずに済みます。
なお、直腸がんに関しては、追加手術を行うことで人工肛門となったり、肛門を残せても肛門機能が低下し、生活の質が低下する可能性もあるため、一定の基準を満たす患者さんには臨床研究として手術の代わりに抗がん剤と放射線治療を併用する治療も行っています。
B)手術
a)I期の一部(固有筋層浸潤がん)、II~III期
内視鏡的摘除の適応とならないI期の一部(固有筋層浸潤がん)、II~III期の大腸がんには手術が推奨されます。また内視鏡的摘除後に追加切除を考慮する組織学的適応基準を満たす大腸がんには手術が検討されます。
手術では、腫瘍が占拠する腸管を十分に切除することに加えて、所属リンパ節を含む腸間膜を十分に摘除すること(リンパ節郭清)が重要です。また、結腸がんと異なり直腸がんは、排便をつかさどる肛門と近接していることや、骨盤内という解剖学的な特異性がある(周囲に膀胱、前立腺、子宮、膣などの他臓器が近接、骨盤内側方に流れるリンパ流が存在)ことにより、治療方針が複雑になります。
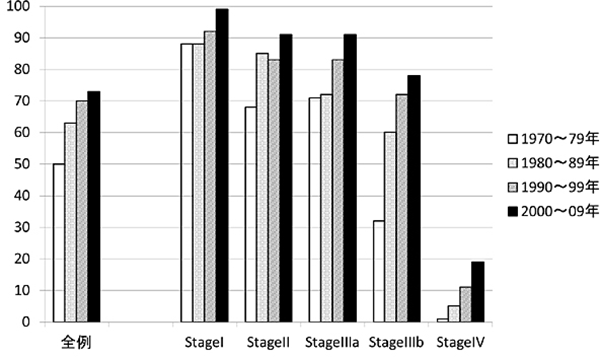
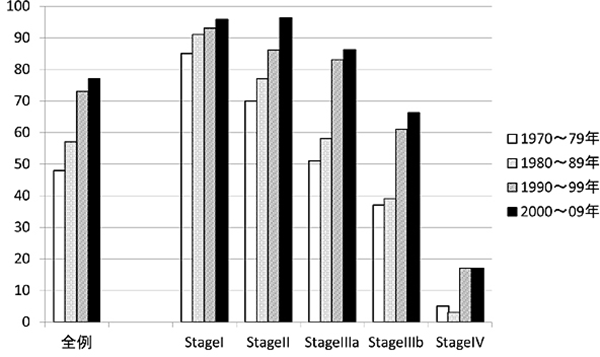
結腸がんにおいて、当院では十分な腸管切除とリンパ節郭清を徹底して追求してきた結果、2000年~2009年の他病死も含めた5年全生存率はI期99%、II期91%、IIIa期91%、IIIb期78%(大腸がん取り扱い規約第7版)という結果でした(図4)。これらの数値は、進行がんでは欧米の教科書に記載されている数値を約10%以上上回っています。
直腸がん治療における一つ目の問題は、排便をつかさどる肛門と近接している点です。かつては直腸を肛門ごと切除して人工肛門を造設する手術が多く行われてきましたが、近年ではがんの根治性を追求しながら肛門温存を図る手術(超低位前方切除術、内括約筋切除術: ISR)も増えてきました。当院でも2019年の直腸がん手術における肛門温存率は88.7%で、言い換えると永久人工肛門となる患者さんが約10%まで減少しました。
二つ目の問題は、骨盤内側方に流れるリンパ流が存在することにより、がんが骨盤側壁のリンパ節に転移しやすい点です。このリンパ節転移は手術後の局所再発の原因となるため、決して見過ごすことはできません。欧米では、初回手術前に骨盤に放射線照射を行うことで局所再発率を減少させる治療が試みられてきた一方、日本では、骨盤側壁のリンパ節を手術で切除する骨盤内リンパ節郭清術が行われてきました。当院ではこの骨盤内リンパ節郭清術を伴う根治性を追求した手術を徹底して行ってきた結果、2000年~2009年の他病死も含めた直腸がんの5年全生存率はI期96%、II期96%、IIIa期86%、IIIb期66%(大腸がん取り扱い規約第7版)という結果でした(図5)。これらの数値も、進行がんでは欧米の教科書に記載されている数値を約10%以上上回っています。
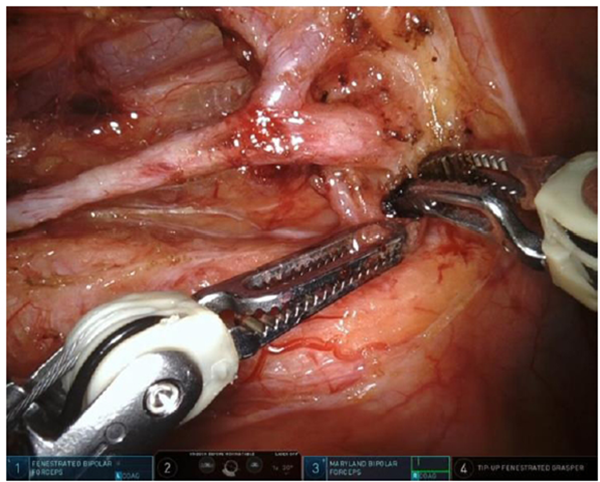
このように、ここ数十年で日本の大腸がんの手術成績は大きく改善しました。最近ではこれらの治療を、根治性を保ちながらより侵襲の低い方法で行う試みが広がっています。低侵襲手術と呼ばれるこれらの試みは、外科医自身が細長い手術器具(鉗子)を腹壁の穴からお腹に入れて手術を行う腹腔鏡手術から始まり、現在では直腸がんにおいて、手術ロボット(DaVinci XiR)が鉗子を用いて手術を行うロボット支援下手術も行われており、当院でも病期・進行度に応じてこれらの低侵襲手術を行っています(図6)。
b)IV期
IV期の大腸がんに対しても、手術による病変の切除が予後の改善に効果があることが知られています。特に肝、肺転移に対しては、可能な限り転移巣の切除が推奨されます。切除においては、臓器の切除範囲と摘出後の生命を維持する残存機能との兼ね合いが問題となります。また、どこまで普通の生活に戻れるかといった患者さんの体力との兼ね合いも重要です。
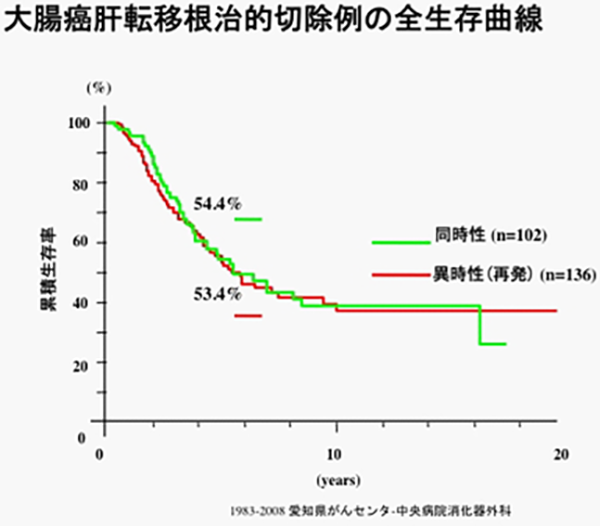
同時性肝転移について、原発巣と転移を全て切除でき、肉眼的に取り残しがなかった場合の5年全生存率は一般的に20-50%と報告されています。当院での同時性肝転移切除例の5年全生存率は54%でした(図7)。肝転移に限らず、切除可能なIV期の大腸がんに対して前後に化学療法を投与することで治療成績を改善する試みが、複数の臨床試験で検討されていますが、その効果は未だ分かっていません。
C)放射線治療
大腸がんのほとんどを占める腺がんに対しては放射線の効果が低いとされています。結腸がんに対しては初回の治療に放射線治療が適応されることはありませんが、欧米では直腸がんに対し初回手術前に骨盤に照射を行い、局所再発率が低下しています。しかし、放射線併用による生存率はあまりかわっていません。日本では、当院も含め進行直腸がんに対して拡大リンパ節郭清が行われますが、手術前の放射線治療を用いない治療成績が優れているため手術前の放射線治療の必要性は低いと考えられており、併用により副作用が増えるリスクの点で一般には行われません。ただし、リスクが高い病気の状態の患者さんには臨床研究として照射の有効性が調査されています。骨や脳に転移した大腸癌には症状を抑えるために放射線治療が行われます。大腸がんのなかで頻度の少ないもので肛門管がんという病気は、他の大腸癌とことなり放射線と化学療法が非常に有効な扁平上皮癌という組織のがんが大部分です。この病気では手術を行った場合に人工肛門が必要になるため、患者さんの負担を減らすため放射線治療と化学療法の併用で肛門を温存する治療が標準です。当院では治療中の副作用をさらに少なく安全に治療するため強度変調放射線治療(intensity modulated radiotherapy IMRT)を標準的に使用しています。
D)術後化学療法
手術的に治癒切除ができた場合もステージIII(および再発率の高いステージII)大腸がんでは、術後に再発の予防を目的として抗がん剤投与を実施することが勧められます。ステージIおよび再発率の低いステージII大腸がんではもとも治癒率が高く、術後に抗がん剤治療を実施しても生存率に差は認められません。現在では、テガフール・ウラシル(UFT)+ロイコボリン(ユーゼル)内服、カペシタビン(ゼローダ)内服、カペシタビン(ゼローダ)内服+オキサリプラチン(エルプラット)点滴静注療法[CAPOX療法]などの選択肢があります。選択する治療によって、再発予防効果と副作用が異なります。抗がん剤の投与期間は術後約6ヶ月間ですが、再発率の高いステージIIと再発率の低いステージIIIに対するCAPOX療法は、6ヶ月から3ヶ月に投与期間を短縮しても再発率が変わらないことがわかったため、副作用の観点から3ヶ月の投与が推奨されます(カペシタビン内服のみの場合は6ヶ月が推奨されます)。また、ステージIVもしくは再発大腸がんであっても、肝転移が治癒切除できた場合、再発の予防を目的として抗がん剤投与を実施することが推奨されます。肺転移や他の臓器の治癒切除後も、肝転移に準じて、抗がん剤投与を実施することが選択肢の1つとなります。
術後のフォローアップ
治癒切除できた方もがんの治癒を見極めるためには少なくとも術後5年の経過観察が必要です。検査で発見できない小さな癌病巣が潜んでいる可能性があるからです。手術後は2から3年まで約3ヶ月ごとの検診と2から3年以後は6ヶ月毎の検診で再発をチェックすることが重要です。再発は主に大腸を切除した部位近傍(局所再発)、肝・肺転移、遠隔リンパ節再発、その他があります。
再発に対する治療
再発した場合にも、可能な限り再発巣の切除が検討されます。切除においては、こちらも臓器の切除範囲と摘出後の生命を維持する残存機能との兼ね合いが問題となります。限られた部位・個数の転移の場合、切除により治癒が得られることがあります。
一般に、再発を全て切除でき、肉眼的に取り残しがなかった場合の肝転移再発の5年全生存率は20-50%と報告されています。当院での肝転移再発切除例の5年全生存率は53%でした(図7)。
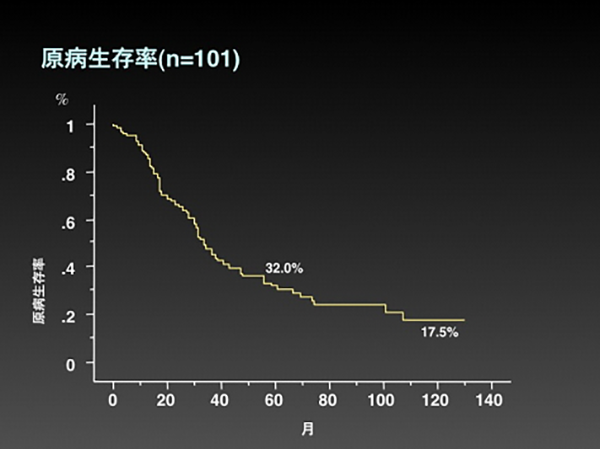
また、再発を全て切除でき、肉眼的に取り残しがなかった場合の骨盤内再発の5年全生存率は20-40%と報告されています。当院での骨盤内再発切除例の5年全生存率は32%でした(図8)。
切除不能例に対する治療
初回診断時や再発時に、根治的に外科切除できない場合には抗がん剤治療が選択されます。大腸がん対する抗がん剤(化学療法)は、フルオロピリミジン(5-FU、カペシタビン、S-1など)、オキサリプラチン、イリノテカンなどの殺細胞性抗がん剤と、ベバシズマブ(アバスチン)、ラムシルマブ(サイラムザ)、アフリベルセプト(ザルトラップ)、セツキシマブ(アービタックス)、パニツムマブ(ベクティビックス)などの分子標的治療薬があります。また、従来の抗がん剤の効果が乏しくなった場合には、TAS-102(ロンサーフ)やレゴラフェニブ(スチバーガ)など新規抗がん剤が使用されます。この中のひとつもしくはいくつかの薬剤(併用療法)を選択し、定められた用法用量により繰り返し実施します。副作用が強いときには、休薬や減量を行います。新しい抗がん剤の登場とともに、従来1年未満であった生存期間中央値は、現在では2年半から約3年に延長してきています。初診時に根治的に外科切除できないと判断された場合でも、抗がん剤治療が奏効して手術可能になる機会も増えてきました。
最近では、がんの個々の遺伝子異常を明らかにし、最適な抗がん剤治療を実施することの重要性が指摘されています。KRAS遺伝子やNRAS遺伝子に異常(変異)がみられる大腸がんでは、セツキシマブやパニツムマブの効果が乏しいことが明らかになっています。また、BRAF遺伝子に変異がみられる大腸がんに有効な治療薬が開発され、保険承認されました。マイクロサテライト不安定性陽性の大腸がんには、ペムブロリズマブ(キイトルーダ)やニボルマブ(オプジーボ)という免疫チェックポイント阻害剤が有効であり、投与が推奨されていますの。当院では、国立がん研究センター東病院を中心に実施されているSCRUM-Japanプロジェクト(GI-SCREEN)に参加し、血液から腫瘍の遺伝子を網羅的に検査する研究を実施しております。

